
科目: 来源: 题型:
【题目】酒石酸(RH2)分子的结构简式为:![]() 。它可以通过电渗析法制备。“三室电渗析”工作原理如图所示(电极均为惰性电极)。下列说法正确的是
。它可以通过电渗析法制备。“三室电渗析”工作原理如图所示(电极均为惰性电极)。下列说法正确的是

A.A为阴离子交换膜,B为阳离子交换膜
B.阴极每生成22.4 L的气体时,转移的电子数为2NA
C.阳极反应为2H2O + 4e![]() O2↑+ 4H+
O2↑+ 4H+
D.若用铅蓄电池作电源,当生成1 mol RH2时,理论上电源的负极增重96 g
查看答案和解析>>
科目: 来源: 题型:
【题目】盐酸和氢氧化钠是工业上重要的化工原料,也是实验室里常见的化学试剂。欲测定某NaOH溶液的物质的量浓度,可用0.1000 mol·L-1 HCl标准溶液进行中和滴定(用酚酞作指示剂)。请回答下列问题:
(1)滴定时,盛装待测NaOH溶液的仪器名称为_____。
(2)碱式滴定管用蒸馏水洗净后,接下来应该进行的操作是_________。
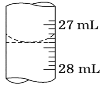
(3)若甲学生在实验过程中,记录滴定前滴定管内液面读数为0.50 mL,滴定后液面如图,则此时消耗标准溶液的体积为_____。
乙学生做了三组平行实验,数据记录如下:
实验序号 | 待测NaOH溶液的体积/mL | 0.1000mol·L-1HCl溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 0.11 | 25.10 |
2 | 25.00 | 1.56 | 33.30 |
3 | 25.00 | 0.21 | 25.22 |
(4)选取上述合理数据,计算出待测NaOH溶液的物质的量浓度为______(保留四位有效数字)。
(5)下列哪些操作会使测定结果偏高_____ (填序号)。
A.锥形瓶用蒸馏水洗净后再用待测液润洗
B.酸式滴定管用蒸馏水洗净后再用标准液润洗
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数
(6)滴定达到终点的标志是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】据图回答下列问题:

(1)若烧杯中的溶液为稀硫酸,则观察到的现象是___________,负极反应式为___________。
(2)若烧杯中的溶液为氢氧化钠溶液,则正极反应为___________,总反应的化学方程式为___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】右图是一种试验某气体化学性质的实验装置,图中B为开关。 如先打开B,在A处通入干燥氯气,C中红色布条颜色无变化;当关闭B时,C处红色布条颜色褪去。则D瓶中盛有的溶液是( )
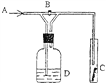
A. 浓H2SO4 B. 浓NaOH溶液
C. 饱和Na2SO4溶液 D. 石灰乳
查看答案和解析>>
科目: 来源: 题型:
【题目】三氯氢硅(SiHCl3)是制备硅烷、多晶硅的重要原料。回答下列问题:
(1)SiHCl3在催化剂作用下发生反应:
2SiHCl3(g)=SiH2Cl2(g)+ SiCl4(g) ΔH1=48 kJ·mol-1
3SiH2Cl2(g)=SiH4(g)+2SiHCl3 (g) ΔH2=30 kJ·mol-1
则反应4SiHCl3(g)=SiH4(g)+3SiCl4(g)的ΔH=__________kJ·mol-1。
(2)对于反应2SiHCl3(g)=SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323K和343K时SiHCl3的转化率随时间变化的结果如图所示。
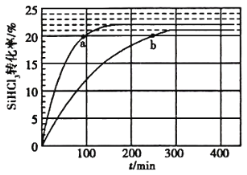
① 343K时反应的平衡转化率α=__________%。平衡常数表达式__________。
②在343K下,要提高SiHCl3转化率,可采取的措施是__________;要缩短反应达到平衡的时间,可采取的措施有__________、__________。
③比较a、b处反应速率大小:va__________vb(填“大于”“小于”或“等于”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】用0.100 mol·L-1 AgNO3滴定50.0 mL 0.0500 mol·L-1 Cl-溶液的滴定曲线如图所示。下列有关描述错误的是
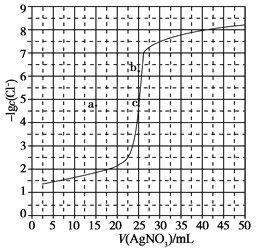
A. 根据曲线数据计算可知Ksp(AgCl)的数量级为10-10
B. 曲线上各点的溶液满足关系式c(Ag+)·c(Cl-)=Ksp(AgCl)
C. 相同实验条件下,若改为0.0400 mol·L-1 Cl-,反应终点c移到a
D. 相同实验条件下,若改为0.0500 mol·L-1 Br-,反应终点c向b方向移动
查看答案和解析>>
科目: 来源: 题型:
【题目】金属铁用途广泛,高炉炼铁的总反应为:Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g),请回答下列问题:
2Fe(s)+3CO2(g),请回答下列问题:
(1)一定温度下,在体积固定的密闭容器中发生上述反应,可以判断该反应已经达到平衡的是___________
A.密闭容器中总压强不变
B.密闭容器中混合气体的平均摩尔质量不变
C.密闭容器中混合气体的密度不变
D.c(CO)=c(CO2)
E.Fe2O3的质量不再变化
(2)一定温度下,上述反应的化学平衡常数为3.0,该温度下将4molCO、2molFe2O3、6molCO2、5molFe加入容积为2L的密闭容器中,此时反应将向________________反应方向进行(填“正”或“逆”或“处于平衡状态”);反应达平衡后,若升高温度,CO与CO2的体积比增大,则正反应为______________反应(填“吸热”或“放热”)。
(3)已知:3Fe2O3(s)+CO(g)![]() 2Fe3O4(s)+CO2(g) △H=–47kJ/mol
2Fe3O4(s)+CO2(g) △H=–47kJ/mol
Fe3O4(s)+CO(g)![]() 3FeO(s)+CO2(g) △H=+19kJ/mol
3FeO(s)+CO2(g) △H=+19kJ/mol
FeO(s)+CO(g)![]() Fe(s)+CO2(g) △H=–11kJ/mol
Fe(s)+CO2(g) △H=–11kJ/mol
则Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g)的 △H=________________。
2Fe(s)+3CO2(g)的 △H=________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】为测定某烃A的分子组成和结构,对这种烃进行以下实验:①取一定量的该烃,使其完全燃烧后的气体通过装有足量无水氯化钙的干燥管,干燥管增重7.2g;再通过足量石灰水,石灰水增重17.6g。②经测定,该烃(气体)在标准状况下的密度为1.25g·L-1。
I.现以A为主要原料合成某种具有水果香味的有机物,其合成路线如图所示。

(1)A分子中官能团的名称是______,E的结构简式为________。
(2)写出以下反应的化学方程式,并标明反应类型。反应③的化学方程式是__________; G是生活中常见的高分子材料,合成G的化学方程式是________________________;
Ⅱ.某同学用如图所示的实验装置制取少量乙酸乙酯,实验结束后,试管甲中上层为透明的、不溶于水的油状液体。
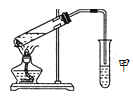
(1)实验开始时,试管甲中的导管不伸入液面下的原因是_______________;当观察到试管甲中________ 现象时认为反应基本完成。
(2)现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,下图是分离操作步骤流程图。
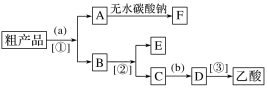
试剂b是____________;分离方法①是__________;分离方法③是________。
(3)在得到的A中加入无水碳酸钠粉末,振荡,目的是________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】阿斯巴甜是一种具有清爽甜味的有机化合物,结构简式如图所示。下列说法不正确的是( )
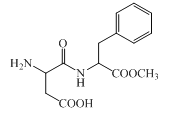
A.分子式为C14H18N2O5
B.不存在顺反异构
C.能发生取代和消去反应
D.1 mol阿斯巴甜完全水解最多消耗3 mol NaOH
查看答案和解析>>
科目: 来源: 题型:
【题目】元素周期表是学习化学的重要工具,它隐含许多信息和规律。下表所列是六种短周期元素的原子半径及主要化合价(已知铍元素的原子半径为0.089 nm)。
元素代号 | A | B | C | D | X | Y |
原子半径/nm | 0.037 | 0.143 | 0.102 | 0.099 | 0.074 | 0.075 |
主要化合价 | +1 | +3 | +6,-2 | -1 | -2 | +5,-3 |
(1)C元素在周期表中的位置为________,其离子结构示意图为:_______。
(2)B的最高价氧化物对应的水化物与Y的最高价氧化物对应的水化物反应的离子方程式为___。
(3)关于C、D 两种元素说法正确的是__________(填序号)。
a.简单离子的半径D>C b.气态氢化物的稳定性D比C强 c.最高价氧化物对应的水化物的酸性C比D强
(4)在100mL18mol/L的C的最高价氧化物对应的水化物的浓溶液中加入过量的铜片,加热使其充分反应,产生气体的体积为6.72L(标况下),则该反应过程中转移的电子数为______。
(5)写出由A、D、X三种元素组成的某种可以消毒杀菌物质的电子式_____________。
(6)比较Y元素与其同族短周期元素的氢化物的熔沸点高低__ >___ (填氢化物化学式),理由___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com