
科目: 来源: 题型:
【题目】磷酸(H3PO4)是一种中强酸,常温下,H3PO4水溶液中含磷微粒的分布分数(平衡时某微粒的浓度占各含磷微粒总浓度的分数)与pH的关系如图,下列说法正确的是( )
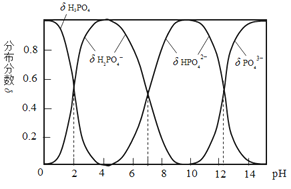
A.H3PO4的电离方程式为:H3PO4![]() 3H++ PO43
3H++ PO43
B.pH=2时,溶液中大量存在的微粒有:H3PO4、H2PO4、HPO42、PO43
C.滴加NaOH溶液至pH=7,溶液中c(Na+)= c(H2PO4)+2c(HPO42)+3c(PO43)
D.滴加少量Na2CO3溶液,3Na2CO3+2H3PO4 =2Na3PO4+3H2O+3CO2↑
查看答案和解析>>
科目: 来源: 题型:
【题目】pH=1的两种酸溶液A、B各1 mL,分别加水稀释到1000 mL,其pH与溶液体积的关系如图所示,下列说法正确的是
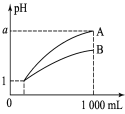
①若a<4,则A、B都是弱酸
②稀释后,A酸溶液的酸性比B酸溶液强
③若a=4,则A是强酸,B是弱酸
④A、B两种酸溶液的物质的量浓度一定相等
A.①④B.②③C.①③D.②④
查看答案和解析>>
科目: 来源: 题型:
【题目】用下列实验装置进行相应实验,装置正确且能达到实验目的的是
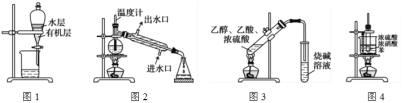
A.用图1所示装置分离用苯萃取碘水后已分层的有机层和水层
B.用图2所示装置进行石油的分馏
C.用图3所示装置制备少量的乙酸乙酯
D.用图4所示装置制取硝基苯
查看答案和解析>>
科目: 来源: 题型:
【题目】2007年诺贝尔化学奖授予埃特尔以表彰其对于合成氨反应机理的研究,氮气和氢气分子在催化剂表面的部分变化过程如图所示,下列说法不正确的是( )
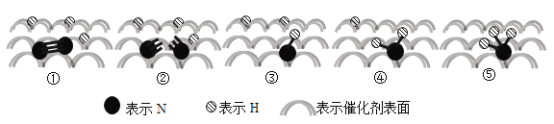
N2(g)+3H2(g)![]() 2NH3(g) △H = 92 kJ/mol
2NH3(g) △H = 92 kJ/mol
A.升高温度不能提高一段时间内NH3的产率
B.图①→②过程吸热,图②→③过程放热
C.N2在反应过程中三键均发生断裂
D.反应过程中存在NH、NH2等中间产物
查看答案和解析>>
科目: 来源: 题型:
【题目】一种用软锰矿(主要成分MnO2)和黄铁矿(主要成分FeS2) 制取MnSO4·H2O并回收单质硫的工艺流程如下:
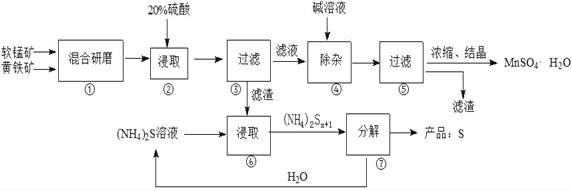
已知:本实验条件下,高锰酸钾溶液与硫酸锰溶液混合产生二氧化锰。
回答下列问题:
(1)步骤①混合研磨成细粉的主要目的是_____________________________________________;步骤②浸取时若生成S、MnSO4及Fe2(SO4)3的化学方程式为_____________________________________。
(2)步骤③所得酸性滤液可能含有Fe2+,为了除去Fe2+可先加入______________________;步骤④需将溶液加热至沸然后在不断搅拌下加入碱调节pH为4~5,再继续煮沸一段时间,“继续煮沸”的目的是_____________________________________。步骤⑤所得滤渣为__________________(填化学式)。
(3)步骤⑦需在90~100℃下进行,该反应的化学方程式为_________________________________。
(4)测定产品MnSO4·H2O的方法之一是:准确称取a g产品于锥形瓶中,加入适量ZnO及H2O煮沸,然后用c mol·L-1KMnO4标准溶液滴定至浅红色且半分钟不褪色,消耗标准溶液VmL,产品中Mn2+的质量分数为w(Mn2+)=________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:A为正盐,常温、常压下,B、C、D、E、G、H、I均为气体,其中D、G、H为单质,气体B能使湿润红色石蕊试纸变蓝,气体E本身为无色气体,但是与空气接触会生成一种红棕色气体I,H为黄绿色气体。F在常温下是一种无色液体。C、J的水溶液分别为两种强酸。图中反应条件(除加热外)均己略去。
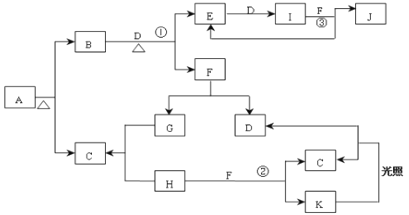
(1)写出它们的化学式:A__、C__、J__。
(2)写出②的离子反应方程式:__。
(3)写出③的化学反应方程式:__。
(4)红热的碳与J的浓溶液反应的化学方程式:__。
(5)J的浓溶液与单质Ag反应的离子方程式为:__。
(6)若86.4g银与含有1.4molJ的浓溶液恰好完全反应,则最终得到气体(NO、NO2)的总物质的量为__mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】为了防止枪支生锈,常将枪支的钢铁零件放在NaNO2和NaOH的混合溶液中进行化学处理使钢铁零件表面生成Fe3O4的致密的保护层——“发蓝”。其过程可用下列化学方程式表示:
①3Fe+NaNO2+5NaOH===3Na2FeO2+H2O+NH3↑
②![]() Na2FeO2+
Na2FeO2+![]() NaNO2+
NaNO2+![]() H2O―→
H2O―→![]() Na2Fe2O4+
Na2Fe2O4+![]() NH3↑+
NH3↑+![]() NaOH
NaOH
③Na2FeO2+Na2Fe2O4+2H2O![]() Fe3O4+4NaOH
Fe3O4+4NaOH
请回答下列问题:
(1)配平化学方程式②,各物质前的化学计量数依次为_____________。
(2)上述反应①中氧化剂为______,被氧化的物质是______。若有2 mol Na2FeO2生成,则反应①中有________mol电子发生转移。
(3)关于“发蓝”的过程,下列说法不正确的是________(填字母)。
A.该过程不会产生污染
B.反应③生成的四氧化三铁具有抗腐蚀作用
C.反应①②③均是氧化还原反应
D.反应①②中的氧化剂均为NaNO2
(4)当混合溶液中NaOH浓度过大,“发蓝”的厚度会变小,其原因是________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氧氟沙星是常用抗菌药,其结构简式如图所示,下列对氧氟沙星叙述错误的是
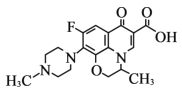
A.能发生加成、取代反应B.能发生酯化反应
C.分子内共有19个氢原子D.分子内共平面的碳原子多于6个
查看答案和解析>>
科目: 来源: 题型:
【题目】已知NA是阿伏加德罗常数的值,下列说法错误的是( )
A.3 g 3He含有的中子数为1NA
B.1 L 0.1 mol·L1磷酸钠溶液含有的![]() 数目为0.1NA
数目为0.1NA
C.1 mol K2Cr2O7被还原为Cr3+转移的电子数为6NA
D.常温下,11g CO2所含的共用电子对数目为NA
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上可利用地沟油作为原料制备乙醇,乙醇可再加工制备多种化工材料。
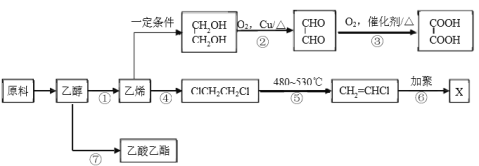
(1)反应②、③实现了官能团的转化:-OH→____________→_____________。
(2)反应④的类型是_______________。
(3)X的结构简式是____________________。
利用如图装置实现反应⑦。
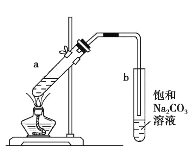
(4)⑦的化学方程式是_________________。
(5)反应结束后,振荡试管b,静置后的现象是__________________。
(6)上述装置中饱和碳酸钠溶液的作用是_______________(填字母代号)。
A.反应掉乙酸和乙醇
B.反应掉乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中的更小,有利于分层析出
D.加速酯的生成,提高其产率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com