
科目: 来源: 题型:
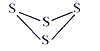
【题目】Ⅰ. (1) 已知S4的结构式如图,反应S4(g) + 4Cl2(s )== 4SCl2(g) △H= - 4 kJ·mol-1,S—S键的键能为266 kJ·mol-1,S—Cl键的键能为255 kJ·mol-1,则1mol Cl2(g)分子中的化学键断裂时需要吸收的能量为_____kJ。
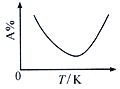
Ⅱ. 工业上合成氯化亚砜反应:SO2(g)+ SCl2(g)+Cl2(s)![]() 2SOCl2(g),该反应中某一反应物的体积分数(以A%表示)随温度的变化关系如图所示。
2SOCl2(g),该反应中某一反应物的体积分数(以A%表示)随温度的变化关系如图所示。
(2) 在373K时,向2L密闭容器中通入物质的量均为0.04 mol的SO2、SCl2与Cl2, 发生上述反应。测得其压强(p)随时间(t)的变化为下表中数据Ⅰ(平衡时的温度与起始温度相同)
t/min | 0 | 1 | 2 | 3 | 4 | 5 |
Ⅰ | 6.0p0 | 6.7 p0 | 6.1 p0 | 5.4 p0 | 5.0 p0 | 5.0 p0 |
Ⅱ | 6.0 p0 | 7.0 p0 | 5.3 p0 | 5.0 p0 | 5.0 p0 | 5.0 p0 |
①该反应的△H_____0(填“>”“<”或“=”)。
②反应开始至达到平衡时,v(SCl2)=__________。
③若只改变某一条件,测得其压强随时间的变化为表中数据Ⅱ,则改变的条件是_______________。
(3) 下图是某同学测定的上述反应的pK(pK= - lgK)与温度的变化关系图。

① A点的数值为_________(已知lg4=0.6)。
②当升高到某一温度时,反应重新达到平衡,A点可能变化为______点。
III. (4) 电解NO2制备NH4NO3,其工作原理如图所示。
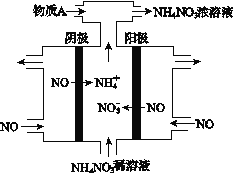
①阴极的电极反应式为_________________________。
②为使电解产物全部转化为NH4NO3,需补充某种物质A,则A的化学式为___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,向一定浓度的Na2X溶液中滴入盐酸,溶液的pH与离子浓度变化关系如图所示。

已知:H2X是二元弱酸,Y表示![]() 或
或![]() ,pY=﹣lgY.下列叙述不正确的是( )
,pY=﹣lgY.下列叙述不正确的是( )
A. 曲线n表示pH与p![]() 的变化关系
的变化关系
B. Ka2(H2X)=1.0×10﹣10.3
C. NaHX溶液中c(H+)>c(OH﹣)
D. 当溶液呈中性时,c(Na+)=c(HX﹣)+2c(X2﹣)+c(Cl﹣)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A. 实验室用氯化铵和熟石灰制氨:NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
B. NaOH溶液与NH4Cl溶液混合加热:NH4+ +OH-![]() NH3·H2O
NH3·H2O
C. 氨水中加盐酸:NH3·H2O+H+=NH4++H2O
D. 氨水中加入氯化铁溶液:Fe2++2NH3·H2O=2NH4++Fe(OH)2↓
查看答案和解析>>
科目: 来源: 题型:
【题目】2A1+MoO3![]() Mo+Al2O3用于制备金属钼(Mo)。下列说法正确的是
Mo+Al2O3用于制备金属钼(Mo)。下列说法正确的是
A.Al得电子B.Al2O3 是氧化剂
C.MoO3 发生还原反应D.每生成1molMo有3mol电子转移
查看答案和解析>>
科目: 来源: 题型:
【题目】我国科学家研发了一种室温下“可呼吸”的Na—CO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na![]() 2Na2CO3+C。下列说法错误的是
2Na2CO3+C。下列说法错误的是

A. 放电时,ClO4-向负极移动
B. 充电时释放CO2,放电时吸收CO2
C. 放电时,正极反应为:3CO2+4e =2CO32-+C
D. 充电时,正极反应为:Na++e=Na
查看答案和解析>>
科目: 来源: 题型:
【题目】B、E、H是生活中常见的有机物,H常用于食品包装,A的产量是石油化工发展水平的标志。根据如图转化关系回答问题:
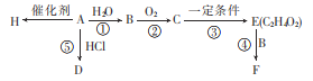
(1)写出A和F中官能团的名称:A___,F___。
(2)反应①、④的反应类型分别为___、___。
(3)写出D和E的结构简式:D___、E___。
(4)请写出下列反应的化学方程式:
I.写出反应②在催化剂存在的条件下并加热的化学方程式:___。
II.A→H的化学方程式:___。
(5)H是一种常见的高分子材料,由这种材料造成的环境问题是___。
查看答案和解析>>
科目: 来源: 题型:
【题目】钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其原理如图所示。下列说法正确的是
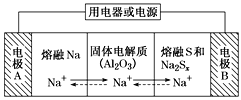
A.放电时,电极A为正极
B.充电时,Na+ 从电极A向电极B迁移
C.充电时,电极B反应式为S22-- 2e- === xS
D.该电池工作的适宜温度应控制在25 ℃左右
查看答案和解析>>
科目: 来源: 题型:
【题目】将湿润的红色石蕊试纸放在进行下列实验的试管口,试纸不变蓝色的有( )
A.加热浓氨水
B.加热NH4HCO3固体
C.加热NH4Cl和Ca(OH)2的混合物
D.加热饱和NH4Cl溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室制取硝基苯的主要步骤如下:
①将配制好的浓硫酸与浓硝酸的混合酸,冷却后加入试管中。
②向混合酸中逐滴加入一定量的苯,充分振荡,混合均匀。
③水浴加热发生反应。
④反应结束后,待混合液冷却后转移至分液漏斗中,除去混合酸,粗产品依次用蒸馏水和10%的Na2CO3溶液洗涤,再用蒸馏水洗涤,得粗硝基苯。
⑤将粗硝基苯用无水CaCl2干燥后蒸馏得到纯硝基苯。

回答下列问题:
(1)配制一定比例浓硫酸和浓硝酸的混合酸的操作是___。
(2)步骤③中,水浴加热的优点是___。
(3)图中长玻璃导管的作用是___。
(4)写出制取硝基苯的化学方程式:___。
(5)步骤④中粗产品用10%的Na2CO3溶液洗涤的目的是___。
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,向体积为2L的恒容密闭容器中通入2molN2和6molH2,在一定条件下发生反应:N2(g)+3H2(g)![]() 2NH3(g)。实验测得反应经5min后达到平衡,此时混合物的总物质的量为5.6mol,求:
2NH3(g)。实验测得反应经5min后达到平衡,此时混合物的总物质的量为5.6mol,求:
(1)平衡时NH3的浓度为___mol·L-1。
(2)0~5min内,v(H2)=___mol·L-1·min-1。
(3)反应达到平衡时,N2的转化率为___。
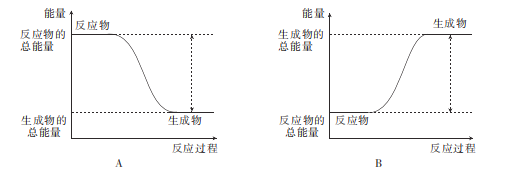
(4)下列图象中能反映该反应的能量变化的是___(填标号)。
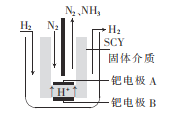
(5)若以N2和H2合成氨的反应设计如图所示的原电池,则通入N2的一极为__(填“正”或“负")极;负极的电极反应式为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com