
科目: 来源: 题型:
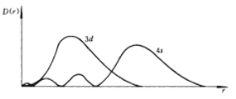
【题目】(1)如图为4s和3d电子云的径向分布图,3d轨道离原子核更近,但是根据鲍林的轨道近似能级图填充电子时,先填4s电子,而后填3d电子,试简单写出理由______。
(2)写出臭氧的Lewis结构式______![]() 只需要写出一种共振式即可
只需要写出一种共振式即可![]() 。
。
(3)根据堆积原理,可以将等径球的密堆积分为![]() 、
、![]() 、
、![]() 、
、![]() 堆积,其中
堆积,其中![]() 堆积形成抽出立方面心晶胞,又叫面心立方最密堆积,其构成的晶胞中含有4个球,写出它们的分数坐标为______。
堆积形成抽出立方面心晶胞,又叫面心立方最密堆积,其构成的晶胞中含有4个球,写出它们的分数坐标为______。
(4)关于![]() 是一个特殊的物质,高温下顺磁性,低温下抗磁性,主要是因为
是一个特殊的物质,高温下顺磁性,低温下抗磁性,主要是因为![]() 与
与![]() 可以相互转化,低温时主要以双聚分子
可以相互转化,低温时主要以双聚分子![]() 形式存在,高温时主要以单分子
形式存在,高温时主要以单分子![]() 形式存在,同时在高温时
形式存在,同时在高温时![]() 分子中存在离域
分子中存在离域![]() 键的存在,使得氧原子没有成单电子,写出
键的存在,使得氧原子没有成单电子,写出![]() 中存在离域
中存在离域![]() 键为______。
键为______。
(5)在相同的杂化类型和相同的孤对电子对数目时,分子的键角也会不相同,试比较![]() 和
和![]() 中键角的大小,
中键角的大小,![]() ______
______![]() 填“大于”或“小于”或“等于”
填“大于”或“小于”或“等于”![]() 。
。
(6)已知饱和硫化氢的浓度为![]() ,硫化氢的离解常数为
,硫化氢的离解常数为![]() ,
,![]() ,计算饱和硫化氢溶液中氢离子的浓度为______。
,计算饱和硫化氢溶液中氢离子的浓度为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑩种元素,请用化学用语回答下列问题:
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | ⑥ | ⑦ | ⑧ | |||||
3 | ① | ③ | ⑤ | ⑨ | ⑩ | |||
4 | ② | ④ |
(1)在③~⑦元素中,原子半径最大的是__________(填元素符号);
(2)⑦元素的最高价氧化物对应的水化物与其氢化物能生成盐M,M中含有的化学键类型有__________________;
(3)写出元素①和⑧的单质在加热条件下反应生成的化合物的电子式:_________。
(4
(5)①~⑨中元素最高价氧化物对应的水化物中酸性最强的是_____________(填物质化学式);呈两性的氢氧化物是_________(填物质化学式),该化合物与NaOH溶液反应的离子方程式为___________。
(6)用电子式表示元素③与⑨形成化合物的过程_____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在铝与稀硫酸的反应中,已知10s末硫酸的浓度减少了0.6mol·L-1,若不考虑反应过程中溶液体积的变化,则10s内生成硫酸铝的平均反应速率是 ( )
A. 1.2mol·L-1·min-1B. 0.02mol·L-1·min-1
C. 1.8mol·L-1·min-1D. 0.18mol·L-1·min-1
查看答案和解析>>
科目: 来源: 题型:
【题目】金属材料在日常生活、生产中有着广泛的运用,下列关于金属的说法不正确的是
A.工业上金属Mg、Al都是用电解熔融的氯化物制得的
B.合金的性质与其成分金属的性质不完全相同
C.金属冶炼的本质是金属阳离子得到电子变成金属原子
D.越活泼的金属越难冶炼
查看答案和解析>>
科目: 来源: 题型:
【题目】将质量为mg的铜屑完全溶于适量浓硝酸中,反应后得到NO2、NO的混合气体,将所得气体通入300mL2molL-1NaOH溶液中,恰好完全反应,生成含NaNO3和NaNO2的盐溶液,其中NaNO3的物质的量为0.2mol,则m的值为( )
A.12.8B.19.2C.25.6D.51.2
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:830℃,在一个密闭容器中发生反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g),平衡常数K=1。某时刻测得容器内各物质的量分别为1.0 mol CO,3.0 mol H2O(g),1.0 mol CO2和1.0mol H2,此时正、逆反应速率的大小关系为:
CO2(g)+H2(g),平衡常数K=1。某时刻测得容器内各物质的量分别为1.0 mol CO,3.0 mol H2O(g),1.0 mol CO2和1.0mol H2,此时正、逆反应速率的大小关系为:
A. v正= v逆B. v正> v逆C. v正< v逆D. 无法确定
查看答案和解析>>
科目: 来源: 题型:
【题目】全钒电池以惰性材料作电极,在电解质溶液中发生的电池总反应为VO2+(蓝色)+H2O+V3+(绿色) ![]() VO2+(黄色)+V2+(紫色)+2H+。下列说法错误的是
VO2+(黄色)+V2+(紫色)+2H+。下列说法错误的是
A. 充电时,反应每生成2 mol H+时转移的电子的物质的量为1 mol
B. 充电时,阳极附近溶液由绿色逐渐变为紫色
C. 放电时,负极反应为V2+-e-===V3+
D. 放电过程中,正极附近溶液的酸性减弱
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,向浓度均为0.1mol·L-1、体积均为100mL的两种一元酸HX、HY溶液中分别加入NaOH固体,溶液中![]() 随n(NaOH)的变化如图所示。下列说法正确的是
随n(NaOH)的变化如图所示。下列说法正确的是

A.HX为弱酸,HY为强酸
B.水的电离程度:b>c>d
C.C点对应的溶液中:c(HY)>c(Y-)
D.若将c点与d点的溶液全部混合,溶液中离子浓度大小:c(Na+)>c(X-)>c(Y-)>c(H+)>c(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】在恒温条件下,向盛有食盐的2L恒容密闭容器中加入0.2molNO2、0.2molNO和0.1molCl2,发生如下两个反应:
①2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) △H1<0平衡常数K1
NaNO3(s)+ClNO(g) △H1<0平衡常数K1
②2NO(g)+Cl2(g)![]() 2ClNO(g) △H2<0 平衡常数K2
2ClNO(g) △H2<0 平衡常数K2
10分钟时反应达到平衡,测得容器内体系的压强减少20%,10分钟内用ClNO(g)表示的平均反应速率v(ClNO)=7.5×10-3mol/(Lmin)。下列说法不正确的是( )
A.反应4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g) 的平衡常数为
2NaNO3(s)+2NO(g)+Cl2(g) 的平衡常数为![]()
B.平衡后c(Cl2)=2.5×10-2mol/L
C.其它条件保持不变,反应在恒压条件下进行,则平衡常数K2增大
D.平衡时NO2的转化率为50%
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)![]() 可用作食盐的抗结剂,高温下
可用作食盐的抗结剂,高温下![]() 会分解生成
会分解生成![]() 、KCN、
、KCN、![]() 、
、![]() C、C等物质,上述物质中涉及的几种元素的第一电离能由大到小的顺序为______;
C、C等物质,上述物质中涉及的几种元素的第一电离能由大到小的顺序为______;![]() 中,铁原子不是采用
中,铁原子不是采用![]() 杂化的理由是______。
杂化的理由是______。
(2)![]() 气态为单分子时,分子中S原子的杂化轨道类型为______,分子的立体构型为______;
气态为单分子时,分子中S原子的杂化轨道类型为______,分子的立体构型为______;![]() 的三聚体环状结构如图1所示,该结构中
的三聚体环状结构如图1所示,该结构中![]() 键长有a、b两类,b的键长大于a的键长的可能原因为______。
键长有a、b两类,b的键长大于a的键长的可能原因为______。

(3)已知:多原子分子中,若原子都在同一平面上且这些原子有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域![]() 键”
键”![]() 或大
或大![]() 键
键![]() 。大
。大![]() 键可用
键可用![]() 表示,其中m、n分别代表参与形成大
表示,其中m、n分别代表参与形成大![]() 键的电子数和原子个数,如苯分子中大
键的电子数和原子个数,如苯分子中大![]() 键表示为
键表示为![]() 。
。
①下列微粒中存在“离域![]() 键”的是______;
键”的是______;
A.![]()
![]()
![]()
![]()
②![]() 分子中大
分子中大![]() 键可以表示为______;
键可以表示为______;
(4)铁、钾两种单质的堆积方式剖面图分别如图2、图3所示。铁晶体中原子的空间利用率为______![]() 用含
用含![]() 的式子表示
的式子表示![]() 。
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com