
科目: 来源: 题型:
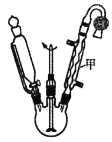
【题目】乙酰乙酸乙酯在医药上常用于合成维生素B。某化学小组在实验室中用如图装置制备乙酰乙酸乙酯。
已知:ⅰ.2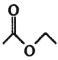
![]()
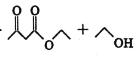
ⅱ.有关物质的性质:
沸点/℃ | 水中溶解性 | |
乙酸乙酯 | 77.2 | 难溶 |
乙酰乙酸乙酯 | 181 | 微溶 |
乙酸 | 118 | 易溶 |
实验步骤:
①向三颈烧瓶中加入9.2g无水乙酸乙酯,迅速加入0.1g切细的金属钠。水浴加热反应液,缓慢回流约2h至金属钠全部反应完。停止加热,冷却后向反应混合物中加入50%乙酸至反应液呈弱酸性。
②向反应混合物中加入等体积的饱和食盐水,分离得到有机层。
③水层用5mL无水乙酸乙酯萃取,分液。
④将①②所得有机层合并,洗涤、干燥、蒸馏得到乙酰乙酸乙酯粗产品。
⑤粗产品纯化得到乙酰乙酸乙酯4.2g。
回答下列问题:
(1)仪器甲的名称是__,水从__(填“上”或“下”)口进入。
(2)步骤②中加入饱和食盐水的作用是__。
(3)步骤④中洗涤时用饱和NaHCO3溶液,目的是__。
(4)步骤⑤中粗产品纯化的操作名称是__。
(5)本实验的产率为__%(结果保留3位有效数字)。
查看答案和解析>>
科目: 来源: 题型:
【题目】取含HCl和MgSO4的混合溶液1L,逐滴加入1molL﹣1的Ba(OH)2溶液,如图为产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)间的关系图,请回答下列问题:
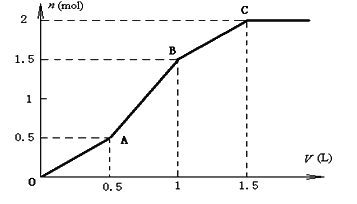
(1)OA段生成沉淀的化学式为______;
(2)AB段生成沉淀的离子方程式为:______;
(3)原溶液中的c(HCl)=______molL﹣1.
查看答案和解析>>
科目: 来源: 题型:
【题目】我国国家标准(GB2760-2011)规定葡萄酒中SO2最大使用量为0.25gL-1。某兴趣小组用图1装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定。
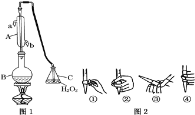
(1)仪器A的名称是 ______,水通入A的进口为 ______。
(2)B中加入300.00mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,其化学方程式为 ______
(3)除去C中过量的H2O2,然后用0.090 0molL-1NaOH标准溶液进行滴定,滴定前排气泡时,应选择图2中的 ______ ;若滴定终点时溶液的pH=8.8,则选择的指示剂为 ______ ;若用50mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积(填序号) ______ (①=10mL;②=40mL;③<10mL;④>40mL)
(4)滴定至终点时,消耗NaOH溶液25.00mL,该葡萄酒中SO2含量为:______ gL-1。
(5)该测定结果比实际值偏高,分析原因并利用现有装置提出改进措施:______。
(6)常温下,用一定量的NaOH溶液吸收逸出的SO2气体,吸收后的吸收液恰好呈中性,下列关于吸收液的说法正确的是______
A. ![]()
B. ![]()
C. ![]()
D. ![]()
E. 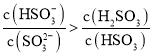
查看答案和解析>>
科目: 来源: 题型:
【题目】设阿伏加德罗常数的值为NA,下列结论错误的是 ( )

A. 完全电解2 mol H2O断裂的σ键键数为4NA
B. 标准状况下,11.2 L CO2中含有的π键键数为2NA
C. 60 g SiO2晶体中含有的Si—O键键数为4NA
D. 128 g金属铜中含有如图所示的晶胞数为0.5NA
查看答案和解析>>
科目: 来源: 题型:
【题目】干燥剂的干燥性能可用干燥干燥效率(1立方米空气中实际余留水蒸气的质量![]() 来衡量
来衡量![]() 某些干燥剂的干燥效率如下:
某些干燥剂的干燥效率如下:
物质 | MgO | CaO | ZnCl2 | ZnBr2 |
干燥效率 | 0.008 | 0.2 | 0.8 | 1.1 |
根据以上数据,有关叙述错误的是
A. MgO的干燥性能比CaO差 B. 干燥效率可能与干燥剂的阴阳离子半径大小有关
C. MgCl2可能是比CaCl2更好的干燥剂 D. 上述干燥剂中阳离子对干燥性能的影响比阴离子大
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是几种常见有机物之间的转化关系图。C具有果香味。
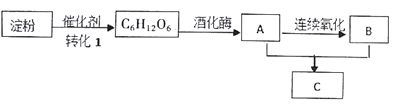
根据以上信息及各物质的转化关系完成下列各题:
(1)A的结构简式为_______,工业上用乙烯生产A的化学方程式为__________。
(2)B物质的俗称为_____,B可与纯碱溶液反应,写出该反应方程式_____________。
(3)A+B→C的化学方程式为__________,反应类型为_________反应。
(4)下列说法正确的是_______。
a.上述有机物中只有C6H12O6属于糖类物质
b.物质A和B都属于电解质
c.物质C和油脂类物质互为同系物
d.转化1可在人体内完成,该催化剂属于蛋白质
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ. 试分析比较合成氨与用SO2和O2反应制SO3的反应:
(1)某些相同点: ①△H ______ 0;②△S ______ 0(填<、=、>);③反应在 ______ 均能自发进行。
(2)条件选择中,主要的三方面不同点?并说明原因和理由?
①______;② ______;③______。
(3)请作出这类反应的“反应过程与能量变化”示意图________________________
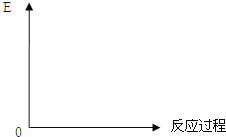
Ⅱ.(4)SO2处理的一种方法是用石灰吸收(“钙基固硫”),其最终生成 ______ (写名称);
(5)实验室里可用“在浓氨水中加生石灰”的方法制取氨气,其理由是 ______ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】糖类、油脂、蛋白质是人体重要的能源物质,请根据它们的性质回答以下问题:
(1)油脂在酸性和碱性条件下水解的共同产物是____________(写名称)。
(2)蛋白质的水解产物具有的官能团是____________和____________(写结构简式)。
(3)葡萄糖是一种重要的单糖,其分子结构中除含有五个羟基外还含有的官能团是____________(写结构简式)
查看答案和解析>>
科目: 来源: 题型:
【题目】向某密闭容器中加入0.3molA、0.1molC和一定量B三种气体。一定条件下发生反应,各物质浓度随时间变化如图甲所示[t0~t1阶段c(B)未画出]。图乙为t2时刻后改变条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种条件并且所用条件均不相同。已知t3~t4阶段为使用催化剂。下列说法正确的是( )
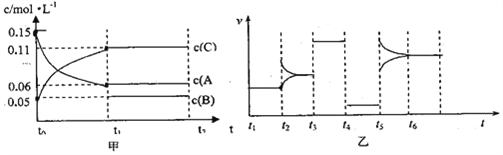
A. 若t1等于15s,生成物C在t0~t1时间段的平均反应速率为0.004mol/(Ls)
B. t4~t5阶段改变的条件为降低反应温度
C. B的起始的物质的量为0.02mol
D. t5~t6阶段可能是增大压强
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.一研究性学习小组对某工业城市的空气污染进行了下列研究。
(1)小组一同学分析“空气质量日报”后初步得出结论,该城市空气污染的主要原因有:A.使用石油液化气 B.燃烧含硫煤 C.粉尘污染另一同学认为还有一个不可排除的原因是:D______。目前城市空气污染的主要有害成分是______ (用化学式表示)。
(2)空气污染形成酸雨.研究性学习小组对该市的雨水进行了采样与分析,刚采集时测得pH为4.82,放在烧杯中经2h后,再次测得pH为4.68.对此,你的合理的解释是______。
Ⅱ.在一密闭容器中发生反应 2NO2![]() 2NO+O2△H>0,反应过程中NO2的浓度随时间变化的情况如图所示,请回答:
2NO+O2△H>0,反应过程中NO2的浓度随时间变化的情况如图所示,请回答:
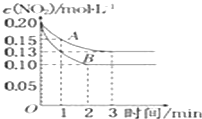
①依曲线A,反应在前3min内氧气的平均反应速率为______。
②若曲线A、B分别表示的是该反应在某不同条件下的反应情况,则此条件可能是______ (填“浓度”、“压强”、“温度”或“催化剂”).
(3)一定温度下,在密闭容器中N2O5可发生下列反应:
①2N2O5 (g) ![]() 4NO2 (g)+O2 (g)
4NO2 (g)+O2 (g)
②2NO2(g) ![]() 2NO(g)+O2 (g)若达平衡时,c(NO2)=0.4mol/L,c(O2)=1.3mol/L,
2NO(g)+O2 (g)若达平衡时,c(NO2)=0.4mol/L,c(O2)=1.3mol/L,
则反应②中NO2的转化率为______,N2O5 (g)的起始浓度应不低于______ mol/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com