
科目: 来源: 题型:
【题目】向温度为300℃的2L密闭容器中充入2molSO2和1molO2发生反应:![]() ,体系达到平衡状态后SO2的浓度为0.1mol/L,下列说法错误的是
,体系达到平衡状态后SO2的浓度为0.1mol/L,下列说法错误的是
A. 该温度下反应的平衡常数K=1620
B. SO2和O2的平衡转化率相等
C. 平衡后保持温度和容器体积不变再充入SO3(g),平衡逆向移动且平衡常数不变
D. 若不再向容器中加入任何物质,改变条件不可能使SO2的浓度达到1mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】设A、B、C代表三种元素,已知①B2―和A+两种离子具有相同的电子层结构,②C元素的原子核内质子数比B元素的原子核内质子数少8个,③B和C两种元素可形成5个原子核(一般简称5核)50个电子的负二价阴离子(提示为:BC42―或为:CB42―)。据此填空:
(1)写出B和C的元素名称:B为_____________,C为_____________。
(2)有A、B、C三种元素形成的含78个电子的盐类化合物的化学式是______________。
(3)某元素X的原子与A元素形成的化合物的化学式为:AX,通过测量发现的式量为76,X原子核内中子数为20,则X属于的元素名称是_____________,用化学符号表示X原子应该是______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学无处不在,下列说法不正确的是![]()
A.硅既可制作光导纤维,也可制作电脑芯片
B.乙酸既可做调味剂,也可除水垢
C.氢氧化铝既可做阻燃剂,也可治疗胃酸过多
D.食盐既可做融雪剂,也可做防腐剂
查看答案和解析>>
科目: 来源: 题型:
【题目】从葡萄籽中提取的原花青素结构如右图所示,具有生物活性,如抗氧化和自由基清除能力等,可防止机体内脂质氧化和自由基的产生而引发的肿瘤等多种疾病。有关原花青素的下列说法不正确的是( )

A. 该物质既可看做醇类,也可看做酚类
B. 1 mol该物质可与4 mol Br2反应
C. 1 mol该物质可与7 mol NaOH反应
D. 1 mol该物质可与7 mol Na反应
查看答案和解析>>
科目: 来源: 题型:
【题目】铝、钛、钡(第2主族)等元素在能源、材料等领域应用广泛。回答下列问题:
⑴与钛同周期的所有副族元素的基态原子中,最外层电子数与基态钛原子相同的元素有________种。基态Ti2+的最外层电子排布式为________________。
⑵铝的逐级电离能数据为:I1=580 kJmol-1、I2=1820 kJmol-1、I3=2750 kJmol-1、I4=11600 kJmol-1。请分析数据规律,预测钡的逐级电离能的第一个数据“突跃”点出现在________之间(用I1、I2、I3等填空![]() 。
。
⑶已知第ⅡA族元素的碳酸盐MCO3热分解的主要过程是:M2+结合碳酸根离子中的氧离子。则CaCO3、BaCO3的分解温度较高的是________________(填化学式),理由是________________。
⑷催化剂M能催化乙烯、丙烯、苯乙烯等的聚合,其结构如图1所示。
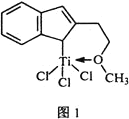
①M中,碳原子的杂化类型有________________。
②M中,不含________![]() 填标号
填标号![]() 。
。
A. π键 B. δ键 C. 配位键 D.氢键 E. 离子键
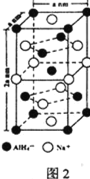
⑸氢化铝钠(NaAlH4)是一种新型轻质储氢材料,其晶胞结构如图2所示,为长方体。写出与AlH4-空间构型相同的一种分子_______________(填化学式)。NaAlH4晶体中,与AlH4-紧邻且等距的Na+有________个;NaAlH4晶体的密度为________ gcm-3(用含a、NA的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知NH3气体34 g,求:(注意书写单位)
(1)NH3的物质的量为__________________。
(2)NH3所含原子总数为__________________。
(3)这些NH3溶于150 mL水后形成溶液,密度为0.9281g/cm3,则其溶液的物质的量浓度为_______________。
(4)与___________gOH-有相同的电子数。
查看答案和解析>>
科目: 来源: 题型:
【题目】H2S(常温下,氢硫酸的Ka1=5.7×10-8,Ka2=1.2×10-15)广泛存在于天然气、合成氨原料气、炼厂气等,生产中需脱硫处理。回答下列问题
(1)著名的 Vanviel反应为2nH2S+nCO2![]() (CH2O)n+nH2O+2nS↓,该反应能量转化形式是________。
(CH2O)n+nH2O+2nS↓,该反应能量转化形式是________。
(2)脱除天然气中H2S的工艺流程如下
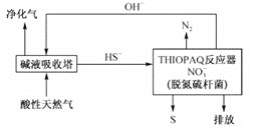
①常温下,“碱液吸收塔”中反应HS-+OH- ![]() S2-+H2O的平衡常数K=________。
S2-+H2O的平衡常数K=________。
②“ THIOPAO”反应器中,在脱氮硫杆菌的作用下,HS-氧化为S的离子方程式为________。
(3)铜(Ⅱ)沉淀及铜(Ⅱ)湿式氧化脱除硫化氢并可回收硫磺,主要步骤如下
(a)吸收H2S
(b)生成CuS沉淀
(c)CuCl2氧化CuS生成单质S和CuCl2-
(d)通O2再生
①常温下,沉淀反应之一:HS-+Cu2+![]() CuS+H+的平衡常数K= ________(已知常温下,KSP(CuS)=4×10-35)。
CuS+H+的平衡常数K= ________(已知常温下,KSP(CuS)=4×10-35)。
②CuCl2氧化CuS的离子方程式为 ________。
③通O2再生时的离子方程式为________ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验用所给实验装置可达到目的的是( )

选项 | 反应原理 |
A |
|
B | CH3COOH+(CH3)2CHCH2CH2OH |
C |
|
D | CH3CH2CH2CH2OH |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,改变0.1mol·L-1的富马酸(H2A)溶液的pH,溶液中的H2A、HA-、A2-的物质的量分数δ(X)[ δ(X)= ![]() ]随pH的变化如图所示。下列叙述正确的是( )
]随pH的变化如图所示。下列叙述正确的是( )

A.pH=3.05时,c(H2A)=c(HA-)=c(OH-)B.pH=4.0时, c(HA-)>C(H2A)>c(A2-)
C.常温下,反应HA-+OH-![]() A2-+H2O的pK=9.51D.常温下,图中x点处:1g
A2-+H2O的pK=9.51D.常温下,图中x点处:1g![]() =0.72
=0.72
查看答案和解析>>
科目: 来源: 题型:
【题目】在373K时,把0.1molN2O4气体通入体积为lL的恒容密闭容器中,立即出现红棕色。在60s时,体系已达平衡,此时容器内压强为开始时的1.6倍。下列说法正确的是( )
A.压缩容器,颜色变浅
B.在平衡时体系内含N2O40.04mol
C.以N2O4的浓度变化表示的平均反应速率为0.002mol/(L·s)
D.平衡时,如果再充入一定量N2O4,则可提高N2O4的转化率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com