
科目: 来源: 题型:
【题目】浓度都是1mol/L的两种气体X2和Y2,在密闭容器中反应生成气体Z,达到平衡后c(X(2)为0.4mol/L,c(Y(2)为0.8mol/L,生成的c(Z)为0.4mol/L,则该反应是
A.3X2+Y2![]() 2X3YB.X2+3Y2
2X3YB.X2+3Y2![]() 2XY3C.X2+2Y2
2XY3C.X2+2Y2![]() 2XY2D.2X2+Y2
2XY2D.2X2+Y2![]() 2X2Y
2X2Y
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,将 0.10 mol·L-1 盐酸滴入 20.00 mL 0.10 mol·L-1 氨水中,溶液中 pH 和 pOH 随加入盐酸体积变化曲线如图所示。已知:pOH=-lg c(OH-),下列正确的是

A. M 点所示溶液中可能存在c(Cl-)> c(NH4+)
B. N 点所示溶液中可能存在:c (NH4+)+ c(NH3﹒H2O)= c(Cl-)
C. Q 点盐酸与氨水恰好中和
D. M 点到Q点所示溶液中水的电离程度先变大后减小
查看答案和解析>>
科目: 来源: 题型:
【题目】对于反应2A+B![]() 3C+4D,表示反应速率最快的是
3C+4D,表示反应速率最快的是
A.VA=0.75mol/(L·s)B.VB=0.5mol/(L·s)C.VC=1.0mol/(L·s)D.VD=1.5mol/(L·s)
查看答案和解析>>
科目: 来源: 题型:
【题目】随原子序数的递增,五种短周期元素原子半径与原子序数的关系如图所示。
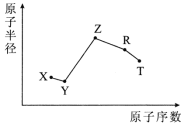
已知:TX2是现代光学及光纤制品的基本原料;
ZY 能破坏水的电离平衡;Z3RY6在工业上常用作助熔剂。
(1)R在元素周期表中的位置是___。
(2)上述元素中的某两种元素可组成一种五原子共价化合物,该化合物的结构式为___。
(3)请用一个化学方程式比较X和Y的非金属性的强弱_____。
(4)工业上以Z3RY6作助熔剂的目的是____。
查看答案和解析>>
科目: 来源: 题型:
【题目】(NH4)3Fe(C6H5O7)2(柠檬酸铁铵)广泛用于医学、食品业等。实验室由硫酸亚铁和柠檬酸(  )等为原料制备柠檬酸铁铵产品的主要实验流程如图:
)等为原料制备柠檬酸铁铵产品的主要实验流程如图:
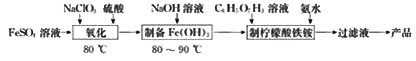
回答下列问题:
(1)“氧化”时,发生反应的离子方程式为________(ClO3-转化为Cl-)。
(2)氧化后的溶液¨制备Fe(OH)3”的详细实验操作为:在不断搅拌下,向氧化后的溶液中________。
(3)“制备柠檬酸铁铵”的装置(夹持及加热装置已略)如图所示

①图中仪器W的名称是________。
②Fe(OH)3与柠檬酸反应时温度需控制在65℃,适宜的加热方法是________;待Fe(OH)3完全溶解后,需将温度降到40℃后再滴加氨水,釆用较低温度滴加氨水,其原因是________ 。
③合适的尾气吸收装置是________(填字母)。
(4)由“过滤液”得到产品还需经过的操作是蒸发浓缩、冷却结晶、________、干燥。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知二元酸H2A的电离方程式为:H2A=H++HA-,HA-![]() H++A2-,下列有关该酸及盐的说法正确的是
H++A2-,下列有关该酸及盐的说法正确的是
A.0.1 mol/LH2A溶液pH=1
B.H2A为强酸
C.NaHA溶液呈酸性的原因是:HA-+H2O![]() H2A+OH-
H2A+OH-
D.Na2A在溶液中不水解,溶液呈中性
查看答案和解析>>
科目: 来源: 题型:
【题目】甲醇是一种重要的化工原料.
![]() 已知:
已知:![]()
![]()
写出表示甲醇燃烧热的热化学方程式 ______ .
![]() 甲醇与水蒸气催化重整可获得清洁能源,具有广泛的应用前景.其反应为:
甲醇与水蒸气催化重整可获得清洁能源,具有广泛的应用前景.其反应为:
![]()
![]()
![]()
![]() 该反应的平衡常数表达式为 ______ .
该反应的平衡常数表达式为 ______ .
![]() 下列措施中能使平衡时
下列措施中能使平衡时![]() 减小的是
减小的是![]() 双选
双选![]() ______ .
______ .
A.加入催化剂![]() 恒容充入
恒容充入![]() ,使体系压强增大
,使体系压强增大
C.将![]() 从体系中分离
从体系中分离![]() 恒容再充入
恒容再充入![]()
![]() 甲醇可以氧化成甲酸,在常温下用
甲醇可以氧化成甲酸,在常温下用![]() NaOH溶液滴定
NaOH溶液滴定![]()
![]() 甲酸溶液过程中,当混合液的
甲酸溶液过程中,当混合液的![]() 时,所消耗的
时,所消耗的![]() ______span>
______span>
![]() 填“
填“![]() ”或“
”或“![]() ”或“
”或“![]() ”
”![]()
![]() .
.
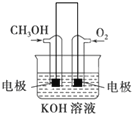
![]() 利用甲醇燃烧设计为燃料电池,如图所示,则负极电极反应式为 ______ .
利用甲醇燃烧设计为燃料电池,如图所示,则负极电极反应式为 ______ .
![]() 合成甲醇的主要反应为:
合成甲醇的主要反应为:![]() 原料气的加工过程中常常混有一些
原料气的加工过程中常常混有一些![]() ,为了研究温度及
,为了研究温度及![]() 含量对该反应的影响,以
含量对该反应的影响,以![]() 、CO和
、CO和![]() 的混合气体为原料在一定条件下进行实验.实验数据见下表:
的混合气体为原料在一定条件下进行实验.实验数据见下表:
|
|
|
|
| ||||||||
反应温度 | 225 | 235 | 250 | 225 | 235 | 250 | 225 | 235 | 250 | 225 | 235 | 250 |
生成 |
|
|
|
|
|
|
|
|
|
|
|
|
由表中数据可得出多个结论.
结论一:在一定条件下,反应温度越高,生成![]() 的碳转化率 ______ .
的碳转化率 ______ .
结论二: ______ .
查看答案和解析>>
科目: 来源: 题型:
【题目】关于沉淀溶解平衡和溶度积常数,下列说法不正确的是( )
A. Ksp只与难溶电解质的性质和温度有关,而与溶液中的离子浓度无关
B. 将饱和Na2SO4溶液加入到饱和石灰水中,有白色沉淀产生,说明Ksp[Ca(OH)2]大于Ksp(CaSO4)
C. 已知25 ℃时Ksp[Fe(OH)3]=4.0×10-38,则该温度下反应Fe(OH)3+3H+![]() Fe3++3H2O的平衡常数K=4.0×104
Fe3++3H2O的平衡常数K=4.0×104
D. 已知25 ℃时Ksp[Mg(OH)2] =1.8×10-11,在MgCl2溶液中加入氨水调混合液的pH=11,产生沉淀,则此时溶液中的c(Mg2+)=1.8×10-5mol·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关实验操作、现象和结论都正确的是( )
选项 | 实验操作 | 现象 | 结论 |
A | 稀硝酸溶液中加入过量铁粉充分反应后,滴加KSCN溶液 | 溶液变为血红色 | 稀硝酸具有氧化性,能将Fe氧化成Fe3+ |
B | 向AgNO3溶液中滴加过量氨水 | 溶液澄清 | Ag+与NH3·H2O能大量共存 |
C | 向某溶液中滴加稀NaOH溶液,将湿润的红色石蕊试纸置于试管口 | 试纸变蓝 | 该溶液中存在NH4+ |
D | 向含有酚酞的Na2CO3溶液中加入少量的BaCl2固体 | 溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
A. AB. BC. CD. D
查看答案和解析>>
科目: 来源: 题型:
【题目】某新型药物H(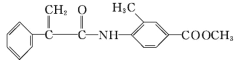 )是一种可用于治疗肿瘤的药物,其合成路线如图所示:
)是一种可用于治疗肿瘤的药物,其合成路线如图所示:
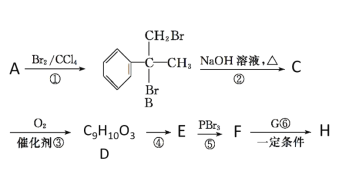
已知:①E的分子式为C9H8O2,能使溴的四氯化碳溶液褪色;
②RCOOH![]()
![]() (R为烃基);
(R为烃基);
③![]()
![]()
![]() 。
。
请回答下列问题:
(1)A的结构简式为________;D的官能团的名称为____________。
(2)①的反应类型是________。
(3)写出B→C的化学方程式: ______________________________________。
(4)E有多种同分异构体,同时满足下列条件的E的同分异构体的结构简式_______。
ⅰ.能发生银镜反应
ⅱ.能发生水解反应
ⅲ.分子中含的环只有苯环,且苯环上只有一个取代基。
(5)参照合成H的上述路线,设计一条由乙醛和NH2CH(CH3)2为起始原料制备医药中间体CH3CONHCH(CH3)2的合成路线。
________________________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com