
科目: 来源: 题型:
【题目】Ⅰ.一定条件下,在体积为5 L的密闭容器中,A、B、C三种气体的物质的量n(mol)随时间t(min)的变化如图所示。已知达平衡后,降低温度,A的体积分数将减小。
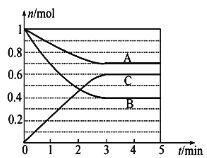
(1)该反应的化学方程式为__________。
(2)该反应的反应速率v随时间t的关系如图所示:
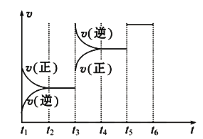
①根据上图判断,在t3时刻改变的外界条件是____________。
②A的转化率最大的一段时间是________。
③各阶段的平衡常数如下表所示:
t2~t3 | t4~t5 | t5~t6 |
K1 | K2 | K3 |
K1、K2、K3之间的大小关系为________(用“>”、“<”或“=”连接)。
Ⅱ.在密闭容器中充入一定量的H2S,发生反应2H2S(g) ![]() 2H2(g)+S2(g) ΔH,如图所示为H2S气体分解生成H2(g)和S2(g)的平衡转化率与温度、压强的关系。
2H2(g)+S2(g) ΔH,如图所示为H2S气体分解生成H2(g)和S2(g)的平衡转化率与温度、压强的关系。
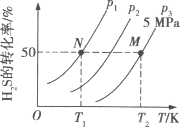
(1)△H___ (填“>”“<”或“ = ”)0。
(2)图中压强(p1、p2、p3)的大小顺序为____。
(3)图中M点的平衡常数Kp =____MPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(4)如果想进一步提高H2S的转化率,除改变温度、压强外,还可以采取的措施有___。
查看答案和解析>>
科目: 来源: 题型:
【题目】用98%的浓硫酸(其密度为1.84 g·cm-3)配制250 mL0.4 mol·L-1稀硫酸,有以下实验仪器供选:A 10mL量筒 B 托盘天平 C 玻璃棒 D 250 mL容量瓶 E 500 mL容量瓶 F 胶头滴管 G. 烧杯
(1)需量取浓硫酸的体积为___________mL。
(2)实验时不可选用的仪器有(填序号) __________________。
(3)配制过程中,下列情况会使配制结果偏高的是_____(填序号)
①容量瓶使用时未干燥;
②定容时俯视刻度线观察液面;
③将浓硫酸在烧杯中稀释后未经冷却就转移至容量瓶中,并定容;
④定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线。
(4)配置过程中,实验操作步骤为: __________
A.在烧杯中注入蒸馏水(溶液体积少于250mL),沿烧杯壁注入量取的浓硫酸用玻璃棒搅拌,使其混匀。
B.待稀释的硫酸冷却后,沿玻璃棒注入250mL的容量瓶中。
C.用量筒量取密度为1.84g/cm3质量分数为98%的浓硫酸。
D.用蒸馏水洗涤烧杯2~3次,将洗涤液注入容量瓶中。
E.往容量瓶中小心加蒸馏水至液面接近刻度1-2cm处,改用胶头滴管加蒸馏水,使溶液凹液面恰好与刻度线相切。
查看答案和解析>>
科目: 来源: 题型:
【题目】氮元素的化合物在工农业以及国防科技中用途广泛,但也会对环境造成污染,如地下水中硝酸盐造成的氮污染已成为一个世界性的环境问题。完成下列填空:
(1)神舟载人飞船的火箭推进器中常用肼(N2H4)作燃料。NH3与NaClO反应可得到肼(N2H4),其他产物性质稳定。该反应中被氧化与被还原的元素的原子个数之比为______。如果反应中有5mol电子发生转移,可得到肼______g。
(2)常温下向25mL1.00mol/L稀盐酸中缓缓通入0.025molNH3(溶液体积变化忽略不计),反应后溶液中离子浓度由大到小的顺序是_____。在通入NH3的过程中溶液的导电能力____(填写“变大”、“变小”或“几乎不变”)。
(3)向上述溶液中继续通入NH3,该过程中离子浓度大小关系可能正确的是_____(选填编号)。
a.[Cl-]=[NH4+]>[H+]=[OH-] b.[Cl-]>[NH4+]=[H+]>[OH-]
c.[NH4+]>[OH-]>[Cl-]>[H+] d.[OH-]>[NH4+]>[H+]>[Cl-]
(4)常温下向25mL含HCl0.01mol的溶液中滴加氨水至过量,该过程中水的电离平衡____(填写电离平衡移动情况)。当滴加氨水到25mL时,测得溶液中水的电离度最大,则氨水的浓度为______mol·L-1。
(5)设计两种实验方案证明氨水是弱电解质(1)_______;(2)_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】I.CO、CO2的应用和治理是当今社会的热点问题。
CO工业上可用于高炉炼铁,发生如下反应: 1/3Fe2O3(s) + CO(g)![]() 2/3Fe(s) + CO2(g),已知该反应在不同温度下的平衡常数如下表:
2/3Fe(s) + CO2(g),已知该反应在不同温度下的平衡常数如下表:
温度/℃ | 1000 | 1150 | 1300 |
平衡常数 | 4.0 | 3.7 | 3.5 |
(1)该反应的正反应为_____反应(填“放热”或“吸热”),欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是____(选填序号)
a.及时吸收或移出CO2 b.增大反应体系的压强
c.用更高效的催化剂 d.粉碎矿石,增大接触面积
(2)一定条件下,在容积一定的容器中,铁和CO2发生反应:Fe(s)+CO2(g)![]() FeO(s)+CO(g)-Q,该反应的平衡常数表达式K=_____________。下列措施中能使平衡时
FeO(s)+CO(g)-Q,该反应的平衡常数表达式K=_____________。下列措施中能使平衡时![]() 增大的是______(选填编号)。
增大的是______(选填编号)。
a.升高温度 b.增大压强
c.充入一定量CO d.再加入一些铁粉
II.合成尿素的反应为:2NH3(g)+CO2(g) ![]() CO(NH2)2(s)+H2O(g)+Q(Q>0)。
CO(NH2)2(s)+H2O(g)+Q(Q>0)。
一定条件下,在10 L的恒容密闭容器中,充入2 mol NH3和1 mol CO2,反应经5 min后达到平衡,测得容器中CO2的浓度为0.05molL-1 。
完成下列填空:
(1)平均反应速率υ(NH3)=____________。
(2)下列描述中能说明上述反应已达平衡的是_________。(填序号)
a.2υ正(NH3)=υ逆(H2O) b.气体的平均相对分子质量不随时间而变化
c.NH3和CO2的比例保持不变 d.气体的压强不再发生变化
(3)为提高尿素的产率,工业上用该反应生产尿素时,合适的反应条件是_______。(填序号)
a.200℃ b.800℃ c.101 kPa d.24000 kPa
查看答案和解析>>
科目: 来源: 题型:
【题目】学习“化学平衡移动原理”后,以你的理解,下列叙述正确的是
A. 对于已达平衡的体系,改变影响化学平衡的条件,不可能出现V正增大,V逆减小的情况。
B. 对2HI![]() H2+I2(g),平衡体系增加压强使颜色变深,可用勒夏特列原理解释。
H2+I2(g),平衡体系增加压强使颜色变深,可用勒夏特列原理解释。
C. 升高温度,一定会使化学平衡发生移动。
D. 在盛有一定量NO2的注射器中,向外拉活塞,其中气体颜色先变浅再变深,甚至比原来深。
查看答案和解析>>
科目: 来源: 题型:
【题目】下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
完成下列填空:
(1)硫原子的核外电子排布式为__,硫原子的核外电子占有__个轨道,Z元素在元素周期表中的位置为__,Y原子核外有______种能量不同的电子。
(2)H2S分子中H-S键键角为92°,说明H2S分子是__(填“极性”“非极性”)分子。
(3)下列事实能说明Y元素的非金属性比硫元素的非金属性强的是__。
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1mol硫单质得电子多
c.Y和硫两元素的简单氢化物受热分解,前者的分解温度高
(4)X与Z两元素的单质反应生成0.1molX的最高价化合物,恢复至室温,放热68.7kJ,已知该化合物的熔、沸点分别为-69℃和58℃,写出该反应的热化学方程式___。
(5)碳酸钠溶液中滴入酚酞,溶液显红色,请用离子方程式解释产生该现象的原因:___;在上述红色的溶液中加入少许氯化钙固体,溶液颜色变浅,请用平衡理论解释产生该现象的原因___。
查看答案和解析>>
科目: 来源: 题型:
【题目】在体积可变的400 ℃密闭容器中,一定量的SO2和O2在催化剂作用下发生反应:2SO2(g)+O2(g) 2SO3(g)+QkJ,下列叙述错误的是( )
2SO3(g)+QkJ,下列叙述错误的是( )
A.增大压强,正反应速率一直增大至不变,平衡正移
B.降低温度,正反应速率比逆反应速率减小的程度小
C.若将三氧化硫分离出,则平衡正向移动,平衡常数K值不变
D.若气体的物质的量减少0.5mol时达到平衡,则该条件下反应放出0.5QkJ的热量
查看答案和解析>>
科目: 来源: 题型:
【题目】一定量的铁粉在氯气中充分燃烧后,将所得固体完全溶于稀盐酸,制得溶液A。
(1)铁在氯气中燃烧的化学方程式是____________________________。
(2)推测A中可能含有的金属阳离子:①Fe3+;②只有Fe2+;③______。
甲同学为探究溶液的组成,实验如下:
实验步骤 | 实验现象 | 实验结论及反应离子方程式 |
取少量溶液A于试管中,加入KSCN溶液。 | ________ | 假设②不成立,假设①或③成立;反应的离子方程式是_____________ 。 |
(3)乙同学继续探究溶液A的组成。
查阅资料:16HCl+2KMnO4=2KCl+2MnCl2+5Cl2↑+8H2O
实验过程:另取少量溶液A于试管中,逐滴加入酸性KMnO4溶液,充分振荡,KMnO4紫色褪去。
实验结论:__________(填写字母序号)。
a.可能有Fe2+ b.可能无Fe2+ c.一定有Fe2+
(4)结论:A中含有的阳离子是_________,简述理由:________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知0.1mol/L的醋酸溶液中存在电离平衡:CH3COOH![]() CH3COO-+H+要使溶液中
CH3COO-+H+要使溶液中![]() 值增大,可以采取的措施是( )
值增大,可以采取的措施是( )
A.加少量烧碱溶液B.降低温度
C.加少量冰醋酸D.加水
查看答案和解析>>
科目: 来源: 题型:
【题目】下列事实不能用化学平衡移动原理解释的是
A.新制氯水长时间放置颜色变浅
B.高压比常压更有利于 SO2 转化为 SO3
C.蒸干 AlCl3 溶液无法得到无水 AlCl3
D.滴加少量 CuSO4 溶液可以加快 Zn 与稀 H2SO4 反应的速率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com