
科目: 来源: 题型:
【题目】高铁酸钠(Na2FeO4)是一种高效、新型的水处理剂,在碱性条件下较稳定;在中性或弱酸性条件下转化为Fe(OH)3和O2;易被H2还原。工业上以黄铁矿(主要成分为FeS2,含有少量NiS、CuS、SiO2等杂质)为原料制备Na2FeO4并回收某些金属资源的工艺流程如图:
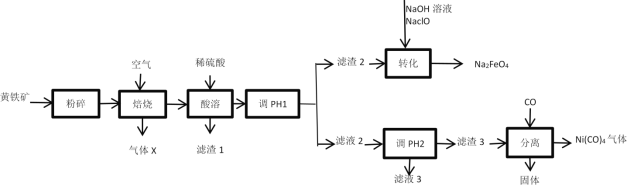
已知:
Ⅰ.“焙烧”后矿石中的金属元素均以氧化物的形式存在。
Ⅱ.溶液中离子浓度小于1×10-5mol/L时,该离子沉淀完全。
(1)“粉碎”的目的是___。
(2)气体X为__,滤渣1为__。
(3)流程中“调节pH1”的实验操作目的是___。
(4)“转化”过程中发生的主要反应的离子方程式为___。
(5)采用电解法制备Na2FeO4的工作原理如图所示:
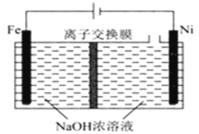
①该装置工作时,阳极的电极反应式为___。
②离子交换膜应选用___(填“阴”或“阳”)离子交换膜,原因____。
查看答案和解析>>
科目: 来源: 题型:
【题目】亚氯酸钠![]() 是重要漂白剂.探究小组开展如下实验,回答下列问题:
是重要漂白剂.探究小组开展如下实验,回答下列问题:
实验Ⅰ:制取![]() 晶体按如图装置进行制取。
晶体按如图装置进行制取。
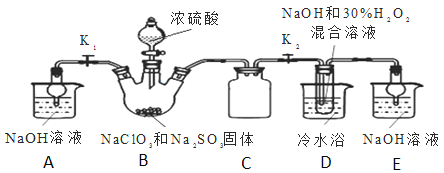
已知:![]() 饱和溶液在低于
饱和溶液在低于![]() 时析出
时析出![]() ,高于
,高于![]() 时析出
时析出![]() ,高于
,高于![]() 时
时![]() 分解成
分解成![]() 和NaCl.
和NaCl.
(1)用![]() 双氧水配制
双氧水配制![]() 的
的![]() 溶液,需要的玻璃仪器除玻璃棒、胶头滴管、烧杯外,还需要______
溶液,需要的玻璃仪器除玻璃棒、胶头滴管、烧杯外,还需要______![]() 填仪器名称
填仪器名称![]() ;
;
(2)装置C的作用是______;
(3)装置B内生成的![]() 气体与装置D中混合溶液反应生成
气体与装置D中混合溶液反应生成![]() ,生成
,生成![]() 的反应方程式为______.
的反应方程式为______.
(4)如果撤去D中的冷水浴,可能导致产品中混有的杂质是______;
(5)反应后,经以下步骤可从装置D的溶液获得![]() 晶体.请补充完整操作iii.
晶体.请补充完整操作iii.
![]() 蒸发结晶;
蒸发结晶;![]() 趁热过滤;iii.______;
趁热过滤;iii.______;![]() 低于
低于![]() 干燥,得到成品.
干燥,得到成品.
实验Ⅱ:样品杂质分析与纯度测定
(6)上述实验制得的![]() 晶体中含少量
晶体中含少量![]() 。产生
。产生![]() 最可能的原因是______;
最可能的原因是______;
![]() 中有
中有![]() 气体产生,并有部分进入D装置内
气体产生,并有部分进入D装置内
![]() 中浓硫酸挥发进入D中与NaOH中和
中浓硫酸挥发进入D中与NaOH中和
![]() 中的硫酸钠进入到D装置内
中的硫酸钠进入到D装置内
(7)测定样品中![]() 的纯度。测定时进行如下实验:
的纯度。测定时进行如下实验:
准确称一定质量的样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生如下反应:![]() ,将所得混合液稀释成100mL待测溶液。
,将所得混合液稀释成100mL待测溶液。
取![]() 待测溶液,加入淀粉溶液做指示剂,用c
待测溶液,加入淀粉溶液做指示剂,用c![]()
![]() 标准液滴定至终点,测得消耗标准溶液体积的平均值为V
标准液滴定至终点,测得消耗标准溶液体积的平均值为V![]() 已知:
已知:![]()
![]() 确认滴定终点的现象是______;
确认滴定终点的现象是______;
![]() 所称取的样品中
所称取的样品中![]() 的物质的量为______
的物质的量为______![]() 用含c、V的代数式表示
用含c、V的代数式表示![]() 。
。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组探究铜丝与足量浓硫酸的反应,装置(已略去夹持装置,其中铜丝可抽动)如图,下列有关说法不正确的是( )
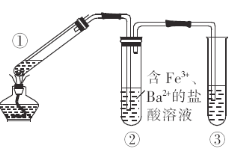
A.①中生成的气体可使品红溶液褪色
B.②中可观察到溶液黄色变浅,且有白色沉淀生成
C.为进行尾气处理,③中装有![]() 溶液
溶液
D.反应后,通过向①中加水,观察溶液颜色可判断反应有硫酸铜生成
查看答案和解析>>
科目: 来源: 题型:
【题目】无水四氯化锡常用作媒染剂和有机合成中的氯化催化剂。实验室可用熔融的锡![]() 熔点
熔点![]() 与
与![]() 反应制备
反应制备![]() ,装置如图。
,装置如图。
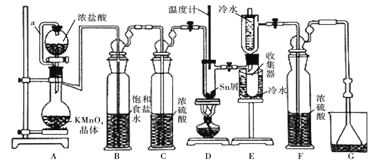
已知:![]() 、
、![]() 有关物理性质:
有关物理性质:
物质 | 颜色、状态 | 熔点/℃ | 沸点/℃ |
SnCl2 | 无色晶体 | 246 | 652 |
SnCl4 | 无色液体 | -33 | 114 |
![]() 极易水解生成
极易水解生成![]() 。回答下列问题:
。回答下列问题:
(1)导管a的作用是____________,装置A中发生反应的离子方程式为____________________。
(2)当观察到装置F液面上方___________时才开始点燃D处的酒精灯,待锡熔化后适当增大氯气流量,继续加热。此时继续加热的目的是![]() ________;
________;![]() ______
______
(3)若上述装置中缺少装置![]() 其它均相同
其它均相同![]() ,则D处具支试管中发生的主要副反应化学方程式为_________________________________。
,则D处具支试管中发生的主要副反应化学方程式为_________________________________。
(4)![]() 和锡的反应产物有
和锡的反应产物有和
![]() ,为防止产品中带入过多的
,为防止产品中带入过多的![]() ,可采取的措施是____________________________________________。
,可采取的措施是____________________________________________。
(5)滴定分析产品中2价![]() Ⅱ
Ⅱ![]() 的含量:用分析天平称取
的含量:用分析天平称取![]() 产品于锥形瓶中,用蒸馏水溶解,加入淀粉溶液,用
产品于锥形瓶中,用蒸馏水溶解,加入淀粉溶液,用![]() 的碘标准溶液滴定至终点时消耗
的碘标准溶液滴定至终点时消耗![]() ,则产品中
,则产品中![]() Ⅱ
Ⅱ![]() 的质量分数为___________。
的质量分数为___________。![]() 小数点后保留2位,已知
小数点后保留2位,已知![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】在0.2L由NaCl、MgCl2、CaCl2组成的混合溶液中,部分离子浓度大小如图所示,回答下列问题:

(1)该混合液中,NaCl的物质的量为_____mol,含溶质MgCl2的质量为_____g。
(2)该混合液中CaCl2的物质的量为_______mol,将该混合液加水稀释至体积为1L,稀释后溶液中Ca2+的物质的量浓度为______mol/L。
查看答案和解析>>
科目: 来源: 题型:
【题目】![]() 是一种常用的还原剂、媒染剂。某化学实验小组在实验室里用如下两种方法来制备无水
是一种常用的还原剂、媒染剂。某化学实验小组在实验室里用如下两种方法来制备无水![]() 。有关物质的性质如下:
。有关物质的性质如下:
C6H5Cl(氯苯) | C6H4Cl2(二氯苯) | FeCl3 | FeCl2 | |
溶解性 | 不溶于水,易溶于苯、乙醇 | 不溶于C6H5Cl、C6H4Cl2、苯,易溶于乙醇,易吸水 | ||
熔点/℃ | -45 | 53 | 易升华 | |
沸点/℃ | 132 | 173 | —— | —— |
(1)用![]() 还原无水
还原无水![]() 制取
制取![]() 。有关装置如图1所示:
。有关装置如图1所示:
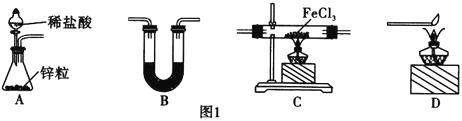
![]() 还原无水
还原无水![]() 制取
制取![]() 的化学方程式为________________________。
的化学方程式为________________________。
![]() 中盛放的试剂是________,按气流由左到右的方向,上述仪器的连接顺序为________
中盛放的试剂是________,按气流由左到右的方向,上述仪器的连接顺序为________![]() 填母,装置可多次使用
填母,装置可多次使用![]() 。
。
![]() 该制备装置的缺点为________________________________。
该制备装置的缺点为________________________________。
(2)利用反应![]() ,制取无水
,制取无水![]() 并测定
并测定![]() 的转化率。按图2装置,在三颈烧瓶中放入
的转化率。按图2装置,在三颈烧瓶中放入![]() 无水氯化铁和过量的氯苯,控制反应温度在一定范围加热3h,冷却、分离提纯得到粗产品。
无水氯化铁和过量的氯苯,控制反应温度在一定范围加热3h,冷却、分离提纯得到粗产品。

![]() 仪器a的作用是________________________。
仪器a的作用是________________________。
![]() 反应结束后,冷却实验装置A,将三颈烧瓶内物质倒出,经过滤、洗涤、干燥后,得到粗产品。洗涤所用的试剂可以是________
反应结束后,冷却实验装置A,将三颈烧瓶内物质倒出,经过滤、洗涤、干燥后,得到粗产品。洗涤所用的试剂可以是________![]() 填名称
填名称![]() ,回收滤液中
,回收滤液中![]() 的操作方法是________。
的操作方法是________。
![]() 在反应开始之前先通一段时间
在反应开始之前先通一段时间![]() 的目的是________________,在反应完成后继续通一段时间
的目的是________________,在反应完成后继续通一段时间![]() 的作用是________________________________。
的作用是________________________________。
![]() 反应后将锥形瓶中溶液配成250mL,量取
反应后将锥形瓶中溶液配成250mL,量取![]() 所配溶液,用
所配溶液,用![]() 溶液滴定,重复上述操作3次,达到滴定终点时消耗NaOH溶液的体积分别为
溶液滴定,重复上述操作3次,达到滴定终点时消耗NaOH溶液的体积分别为![]() 、
、![]() 、
、![]() ,则氯化铁的转化率为________________。
,则氯化铁的转化率为________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是石蜡油在炽热碎瓷片的作用下产生C2H4并检验C2H4性质的实验,完成下列各问题

(1)B中溶液褪色,是因为乙烯被_______________;
(2)C中发生反应的化学方程式________________;
(3)在D处点燃时必须进行的操作是________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某种溶液可能含有下列阴离子中的一种或几种:![]() 、
、![]() 、Cl。
、Cl。
(1)当溶液中有大量H+存在时,则不可能有________存在。
(2)当溶液中有大量Ba2+存在时,溶液中不可能有________存在。
(3)当溶液中有________和________等阳离子存在时,上述所有阴离子都不可能存在。
查看答案和解析>>
科目: 来源: 题型:
【题目】写出下列反应的化学方程式,并注明(1)、(2)、(3)的反应类型
(1)由乙烯制备聚乙烯的反应 _______________反应类型:_________________
(2)用甲苯制TNT的反应 __________________反应类型:_________________
(3)溴乙烷与NaOH的乙醇溶液共热 _________________反应类型:_____________
(4)烯烃在一定条件下氧化时,由于C=C键断裂,转化为醛、酮,如:![]() 。若
。若![]() 在上述类似条件下发生反应,请写出反应的方程式 _________________________ 。
在上述类似条件下发生反应,请写出反应的方程式 _________________________ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】高铁酸盐是优良的多功能水处理剂。某实验小组采用如图装置制备高铁酸钾![]() 并探究其性质用途。
并探究其性质用途。
资料:![]() 为紫色固体,微溶于KOH溶液,难溶于有机溶剂;具有强氧化性,在酸性或中性溶液中紫色快速褪去并产生
为紫色固体,微溶于KOH溶液,难溶于有机溶剂;具有强氧化性,在酸性或中性溶液中紫色快速褪去并产生![]() ,在碱性溶液中较稳定。
,在碱性溶液中较稳定。
Ⅰ![]() 制备
制备![]() 夹持、加热等装置略
夹持、加热等装置略![]()

(1)![]() 中发生反应的化学方程式为________________;B中所用试剂为________________。
中发生反应的化学方程式为________________;B中所用试剂为________________。
(2)C中反应为放热反应,而反应温度须控制在![]() ,可使用的控温方法为________,充分反应后得到紫色固体,反应方程式为________________________。反应中KOH必须过量的原因是________________________。
,可使用的控温方法为________,充分反应后得到紫色固体,反应方程式为________________________。反应中KOH必须过量的原因是________________________。
(3)C中混合物经过滤、洗涤、干燥,得纯净高铁酸钾晶体,洗涤时洗涤剂可选用________。
![]() 冰水
冰水 ![]() 溶液
溶液 ![]() 异丙醇
异丙醇
Ⅱ![]() 探究
探究![]() 的性质
的性质
(4)![]() 可以将废水中的
可以将废水中的![]() 氧化为
氧化为![]() ,实验表明,
,实验表明,![]() 时
时![]() 去除效果最佳。配平反应离子方程式:______FeO42-+___________CN-__________H2O→Fe(OH)3↓+_______CNO-_________OH-。_________
去除效果最佳。配平反应离子方程式:______FeO42-+___________CN-__________H2O→Fe(OH)3↓+_______CNO-_________OH-。_________
现处理含![]() 离子浓度为
离子浓度为![]() 的废水
的废水![]() ,至少需要
,至少需要![]() ________g。
________g。
(5)用滴定分析法测定样品中![]() 的纯度:现称取
的纯度:现称取![]() 制备的样品溶于适量氢氧化钾溶液中,加入稍过量的
制备的样品溶于适量氢氧化钾溶液中,加入稍过量的![]() ,充分反应后过滤,滤液定容于250mL容量瓶中。
,充分反应后过滤,滤液定容于250mL容量瓶中。
每次取![]() 加入稀硫酸酸化,用
加入稀硫酸酸化,用![]() 的
的![]() 标准溶液滴定,三次滴定消耗标准溶液的平均体积为
标准溶液滴定,三次滴定消耗标准溶液的平均体积为![]() 。有关反应的离子方程式为:
。有关反应的离子方程式为:
![]() ;
;
![]() ;
;
![]() 。
。
样品中高铁酸钾的质量分数为________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com