
科目: 来源: 题型:
【题目】某同学将铁铝合金样品溶解后取样25.00mL,分离并测定Fe3+的浓度,实验方案设计如下:

已知:乙醚[(C2H5)2O]是一种易挥发、易燃、有麻醉性的有机化合物,沸点为34.5度,微溶于水,在较高的盐酸浓度下,Fe3+与HCl、乙醚形成化合物[(C2H5)2OH][FeCl4]而溶于乙醚,当盐酸浓度降低时,该化合物解离。
请回答:
(1)操作A的名称是______________。
(2)经操作A后,为判断Fe3+是否有残留,请设计实验方案_____________________。
(3)蒸馏装置如下图所示,装置中存在的错误是_______________________________。
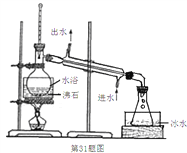
(4)滴定前,加入的适量溶液B是_________。
A.H2SO3—H3PO4 B.H2SO4—H3PO4
C.HNO3—H3PO4 D.HI—H3PO4
(5)滴定达到终点时,消耗0.1000 mol·L-1 K2Cr2O7溶液6.00mL。根据该实验数据,试样X中c(Fe3+)为____________。
(6)上述测定结果存在一定的误差,为提高该滴定结果的精密度和准确度,可采取的措施是_______。
A.稀释被测试样 B.减少被测试样取量
C.增加平行测定次数 D.降低滴定剂浓度
查看答案和解析>>
科目: 来源: 题型:
【题目】ClO2是一种优良的消毒剂,浓度过高时易发生分解,常将其制备成NaClO2固体以便运输和贮存。过氧化氢法制备NaClO2固体的实验装置如图所示。

已知:2NaClO3+H2O2+H2SO4=2ClO2↑+O2↑+Na2SO4+2H2O
2ClO2+H2O2+2NaOH=2NaClO2+O2↑+2H2O
ClO2熔点-59 ℃、沸点11 ℃;H2O2沸点150 ℃。
请回答:
(1)仪器A的名称为________;仪器B的作用是________;冰水浴冷却的目的是____________(写出两种)。
(2)空气流速过快或过慢,均降低NaClO2产率,试解释其原因______________。
(3)Cl-存在时会催化ClO2的生成。反应开始时在三颈烧瓶中加入少量盐酸,ClO2的生成速率大大提高,并产生微量氯气。该过程可能经两步反应完成,将其补充完整:①_______________________________(用离子方程式表示),②H2O2+Cl2=2Cl-+O2+2H+。
查看答案和解析>>
科目: 来源: 题型:
【题目】![]() 是生活中常见的物质,请回答下列问题:
是生活中常见的物质,请回答下列问题:
(1)写出![]() 在水溶液中电离的方程式:______________。
在水溶液中电离的方程式:______________。
(2)![]() 属于“酸”“碱”“盐”中的________________________。
属于“酸”“碱”“盐”中的________________________。
(3)①写出![]() 溶液与
溶液与![]() 溶液反应的离子方程式:___________________________。
溶液反应的离子方程式:___________________________。
②写出![]() 溶液与
溶液与![]() 溶液反应的离子方程式:_____________________________________。
溶液反应的离子方程式:_____________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】铋![]() 及其化合物广泛应用于电子、医药等领域。由辉铋矿(主要成分为
及其化合物广泛应用于电子、医药等领域。由辉铋矿(主要成分为![]() ,含杂质
,含杂质![]() 、
、![]() 等)制备
等)制备![]() 的工艺如下(已知水解能力:
的工艺如下(已知水解能力:![]() )
)
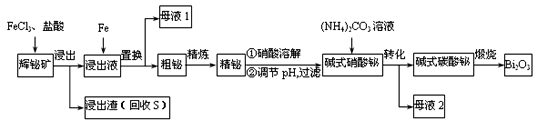
回答下列问题:
(1)为了提高浸出率,可采取的措施有_______________。(任写一条)
(2)“浸出”时![]() 与
与![]() 溶液反应的化学方程式为__________________________,盐酸的作用_________________________________________。
溶液反应的化学方程式为__________________________,盐酸的作用_________________________________________。
(3)“母液2”中主要溶质的化学式为________。
(4)“粗铋”中含有的主要杂质是Pb,可通过电解精炼除杂。电解质为熔融![]() 、KC1,电解后精铋留在粗铋电极下方电解槽底部。电解时,粗铋与电源_____(填“正”或“负”)极相连。阴极的电极反应为__________________________,铅元素的金属性比铋元素______。(填“强”“弱”或“不能确定”)。
、KC1,电解后精铋留在粗铋电极下方电解槽底部。电解时,粗铋与电源_____(填“正”或“负”)极相连。阴极的电极反应为__________________________,铅元素的金属性比铋元素______。(填“强”“弱”或“不能确定”)。
(5)碱式硝酸铋直接灼烧也能得到![]() ,上述工艺中转化为碱式碳酸铋再灼烧的优点是_________。
,上述工艺中转化为碱式碳酸铋再灼烧的优点是_________。
(6)常温下,向浓度均为![]() 的
的![]() 、
、![]() 的混合溶液中滴加
的混合溶液中滴加![]() 溶液,先生成__________沉淀,通过计算说明______________________________。[已知:Ksp(PbS) = 3.0×10-28,Ksp(Bi2S3) = 1.0×10-20]
溶液,先生成__________沉淀,通过计算说明______________________________。[已知:Ksp(PbS) = 3.0×10-28,Ksp(Bi2S3) = 1.0×10-20]
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:A、B、C、D、E、F是周期表中前36号元素,A是原子半径最小的元素,B元素基态原子的2P轨道上只有两个电子,C元素的基态原子L层只有2对成对电子,D是元素周期表中电负性最大的元素,E2+的核外电子排布和Ar原子相同,F的核电荷数是D和E的核电荷数之和。
请回答下列问题:
(1)分子式为BC2的空间构型为__ __;F2+的核外电子排布式为 。
(2)A分别与B、C形成的最简单化合物的稳定性B____C(填“大于”或“小于”);A、C两元素可组成原子个数比为1:1的化合物,C元素的杂化类型为 。
(3)A2C所形成的晶体类型为_ ___;F单质形成的晶体类型为 ,其采用的堆积方式为 。
(4)F元素氧化物的熔点比其硫化物的____(填“高”或 “低”),请解释其原因____。
(5)D跟E可形成离子化合物,其晶胞结构如右图。该离子化合物晶体的密度为pg.cm。3,则晶胞的体积是 。(用含p的代数式表示)。

查看答案和解析>>
科目: 来源: 题型:
【题目】化学与生产、生活、社会密切相关.下列有关说法中不正确的是
A.2008年北京奥运会开幕式上的“脚印”等焰火让全世界为之欢呼、倾倒,这主要是利用了化学中“焰色反应”的有关知识
B.神七宇航员所穿航天服是由我国自行研制的新型“连续纤维增韧”航空材料做成,其主要成分是由碳化硅、陶瓷和碳纤维复合而成的,它是一种新型无机非金属材料
C.腌制食品中应严格控制![]() 的用量
的用量
D.从海水中可提取Mg,用惰性电极电解熔融的![]() 或其水溶液都可制得Mg
或其水溶液都可制得Mg
查看答案和解析>>
科目: 来源: 题型:
【题目】乙烯雌酚是人工合成的激素类药物,对垂体促性腺激素的分泌有抑制作用,能改善体内激素的平衡状态,破坏肿瘤组织赖以生长发育的条件,对治疗前列腺癌和乳腺癌有明显的疗效,其结构如下:
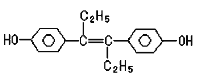
下列有关叙述中正确的是:
A.乙烯雌酚的分子式为C18H22O2B.乙烯雌酚可与NaOH和NaHCO3发生反应
C.1mol该有机物可以与7mol Br2发生反应D.该有机物分子中一定有8个碳原子共平面
查看答案和解析>>
科目: 来源: 题型:
【题目】由徐光宪院士发起,院士学子同创的《分子共和国》科普读物最近出版了,全书形象生动地诉说了BF3、TiO2、CH3COOH、CO2、NO、二茂铁、NH3、HCN、H2S、O3、异戊二烯和萜等众多“分子共和国”中的明星。
(1)写出Fe2+的核外电子排布式________________________________。
(2)下列说法正确的是________。
a.H2S、O3分子都是直线形
b.BF3和NH3均为三角锥形
c.CO2、HCN分子的结构式分别是O=C=O、H—C≡N
d.CH3COOH分子中碳原子的杂化方式有:sp2、sp3
(3)TiO2的天然晶体中,最稳定的一种晶体结构如图, 白球表示________原子。
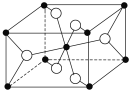
(4)乙酸(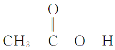 )熔沸点很高,是由于存在以分子间氢键缔合的二聚体(含一个环状结构),请画出该二聚体的结构:_________________________________________。
)熔沸点很高,是由于存在以分子间氢键缔合的二聚体(含一个环状结构),请画出该二聚体的结构:_________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业废弃物的资源化回收再利用,可以更大限度地发挥原材料的价值。下图是工业生产纳米磁性氧化铁的流程:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
下列说法不正确的是
A.用Na2CO3溶液浸泡是为了除去废铁屑表面的油污
B.若生产中不通入N2,暴露在空气中生产,将不能得到高纯度产品
C.加适量的H2O2是为了将部分Fe2+氧化为Fe3+ ,涉及的反应:H2O2+2Fe2++2H+=2Fe3++2H2O
D.溶液A中Fe2+和Fe3+的浓度比为2∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com