
科目: 来源: 题型:
【题目】碳、硫、氮及其化合物在工农业、国防等领域占有重要地位。
(1)已知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2
若16gCH4和NO2充分反应,生成N2、CO2(g)和H2O(g),共放出热量867kJ,则△H2=___。
(2)工业生产中产生的SO2废气若用Na2SO3溶液吸收,得到浓度均为0.1mol·L-1的Na2SO3、NaHSO3混合溶液,则![]() =__。经测定,所得溶液呈酸性,则溶液中离子浓度由大到小的顺序为___。
=__。经测定,所得溶液呈酸性,则溶液中离子浓度由大到小的顺序为___。
(3)N2O4与NO2之间存在反应N2O4(g)2NO2(g)。在一定条件下,该反应N2O4、NO2的消耗速率与自身压强间存在关系v(N2O4)=k1p(N2O4),v(NO2)=k2p2(NO2),其中k1、k2是与反应温度有关的常数。相应的速率-分压强关系如图所示,一定温度下,k1、k2与平衡常数Kp(用平衡分压代替平衡浓度计算)的关系是k1=__,在图上标出的点中,能表示反应达到平衡状态的点为__(填字母代号)。

(4)在有氧条件下,新型催化剂M能催化NH3与NOx反应生成N2。
①NH3与NO2生成N2的反应中,当生成1molN2时,转移的电子为___mol。
②将一定比例的O2、NH3和NOx的混合气体,匀速通入装有催化剂M的反应器中反应(装置见图1)。反应相同时间NOx的去除率随反应温度的变化曲线如图2所示,在50~250℃范围内随着温度的升高,NOx的去除率先迅速上升后上升缓慢的主要原因是___;当反应温度高于380℃时,NOx的去除率迅速下降的原因可能是___。

查看答案和解析>>
科目: 来源: 题型:
【题目】相同温度下,根据三种酸的电离平衡常数,下列判断正确的是![]()
酸 | HX | HY | HZ |
|
|
|
|
A.三种酸的强弱关系: ![]()
B.反应 ![]() 能够发生
能够发生
C.相同温度下,![]() 的NaX、NaY、NaZ溶液,NaZ溶液pH最大
的NaX、NaY、NaZ溶液,NaZ溶液pH最大
D.相同温度下,![]() 溶液的电离常数大于
溶液的电离常数大于![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)甘氨酸的结构简式为![]() ,其中含氧官能团的名称是____________,该物质是____________性化合物。
,其中含氧官能团的名称是____________,该物质是____________性化合物。
(2)以乙炔、HCl等有关试剂在一定条件下合成聚氯乙烯的流程如下:
![]()
①指出反应Ⅱ的反应类型是____________。
②写出反应I的化学方程式________________________________
(3)1 mol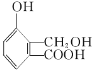 最多能与________________mol NaOH发生反应。
最多能与________________mol NaOH发生反应。
查看答案和解析>>
科目: 来源: 题型:
【题目】氯气是一种重要的工业原料,液氯储存区贴有的说明卡如下:
包装 | 钢瓶 |
储运要求 | 远离金属粉末、氨、烃类、醇类物质;设置氯气检测仪 |
泄漏处理 | NaOH、NaHSO3溶液吸收 |
下列解释事实的方程式不正确的是
A. 氯气用于自来水消毒:Cl2 + H2O![]() 2H+ + Cl-+ ClO-
2H+ + Cl-+ ClO-
B. 电解饱和食盐水制取Cl2:2Cl- +2H2O![]() 2OH-+ H2↑+Cl2↑
2OH-+ H2↑+Cl2↑
C. 浓氨水检验泄露的氯气,产生白烟:8NH3 + 3Cl2 === 6 NH4Cl + N2
D. 氯气“泄漏处理”中NaHSO3溶液的作用:HSO3-+ Cl2 + H2O === SO42-+ 3H+ + 2Cl-
查看答案和解析>>
科目: 来源: 题型:
【题目】在25 ℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/(mol·L-1) | 0.1 | 0.2 | 0 |
平衡浓度/(mol·L-1) | 0.05 | 0.05 | 0.1 |
下列说法错误的是( )
A.增大压强使平衡向生成Z的方向移动,平衡常数增大
B.反应可表示为X+3Y![]() 2Z,其平衡常数为1600
2Z,其平衡常数为1600
C.反应达平衡时,X的转化率为50%
D.改变温度可以改变此反应的平衡常数
查看答案和解析>>
科目: 来源: 题型:
【题目】PVAc是一种具有热塑性的树脂,可合成重要高分子材料M,合成路线如下:
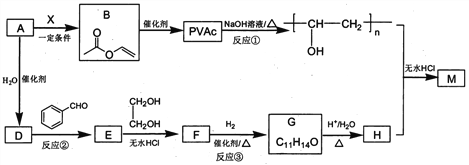
己知:R、Rˊ、Rˊˊ为H原子或烃基
I. R'CHO+ R"CH2CHO![]()
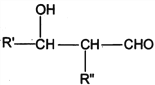
![]()
![]()
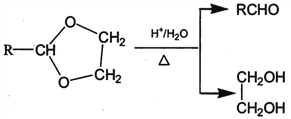
II. RCHO+![]()
![]()
(1)标准状况下,4.48L气态烃A的质量是5.2g,则A的结构简式为___________________。
(2)己知A→B为加成反应,则X的结构简式为_______;B中官能团的名称是_________。
(3)反应①的化学方程式为______________________。
(4)E能使溴的四氯化碳溶液褪色,反应②的反应试剂和条件是_______________________。
(5)反应③的化学方程式为____________________________。
(6)在E→F→G→H的转化过程中,乙二醇的作用是__________________________。
(7)己知M的链节中除苯环外,还含有六元环状结构,则M的结构简式为_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】环戊二烯(![]() )是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产,环戊二烯容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是
)是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产,环戊二烯容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是
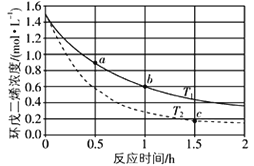
A.T1>T2
B.a点的反应速率小于c点的反应速率
C.a点的正反应速率小于b点的逆反应速率
D.b点时二聚体的浓度为0.45 mol·L1
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,发生反应:①M(s)+N(g) R(g) ΔH= - Q1 kJ/mol
②2 R(g)+N(g) 2T(g) ΔH= - Q2 kJ/mol(已知Q1、Q2、Q3均为正值)
下列说法正确的是
A. 1molR(g)的能量总和大于1molM(s)与1molN(g)的能量总和
B. 将2mol R(g)与1molN(g)充分混合,在一定条件下充分反应,放出热量Q2 kJ
C. 当1molM(s)完全转化为T(g)时(假定无热量损失),放出热量(Q1+0.5Q2)kJ
D. M(g)+N(g) R(g) ΔH= - Q3 kJ/mol,则Q3 < Q1
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述中,不能用勒夏特列原理解释的是( )
A.红棕色的NO2,加压后颜色先变深后变浅
B.高压比常压有利于合成SO3
C.工业制取金属钾Na(l)+KCl(l) NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出来
D.加入催化剂有利于氨的合成
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关化学反应速率和化学平衡影响的图象,其中图象和实验结论表达错误的是




A. a是其他条件一定时,反应速率随温度变化的图象,正反应ΔH > 0
B. b是在有无催化剂存在下建立的平衡过程图象,Ⅰ是使用催化剂时的曲线
C. c是一定条件下,向含有一定量A的容器中逐渐加入B时的图象,压强p1 > p2
D. d是在平衡体系的溶液中溶入少量KCl固体后化学反应速率随时间变化的图象
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com