
科目: 来源: 题型:
【题目】铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与11.2 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。则消耗铜的质量为
A. 32 g B. 48 g C. 64 g D. 96 g
查看答案和解析>>
科目: 来源: 题型:
【题目】![]() 已知:
已知:![]()
![]() ;
;![]() ,根据上述信息,写出C转化为CO的热化学方程式_________________________________________。
,根据上述信息,写出C转化为CO的热化学方程式_________________________________________。
![]() 已知热化学方程式:
已知热化学方程式:![]()
![]() ,该反应的活化能为
,该反应的活化能为![]() ,则其逆反应的活化能为___________
,则其逆反应的活化能为___________![]()
![]() 用
用![]() 催化还原
催化还原![]() 可以消除氮氧化物的污染。例如:
可以消除氮氧化物的污染。例如:
![]()
![]()
![]()
![]()
若用标准状况下![]() 还原
还原![]() 生成
生成![]() ,反应中转移的电子总数为_______
,反应中转移的电子总数为_______![]() 用阿伏加德罗常数
用阿伏加德罗常数![]() 表示
表示![]() ,放出的热量为_______kJ。
,放出的热量为_______kJ。
![]() 已知
已知![]() ;
;![]() 。蒸发1mol
。蒸发1mol![]() 需要吸收的能量为30J,其它相关数据如下表,则表中 a为__________________
需要吸收的能量为30J,其它相关数据如下表,则表中 a为__________________
|
|
|
|
1mol分子中的化学键断裂时 需要吸收的能量 | 436 | a | 369 |
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D是四种短周期元素,E是过渡元素。A、B、C同周期,C、D同主族,A的原子结构示意图为:![]() ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。
回答下列问题:
(1)用元素符号表示D所在周期(除稀有气体元素外)第一电离能最大的元素是__________,电负性最大的元素是__________。
(2)D的氢化物比C的氢化物的沸点_____(填"高"或"低"),原因____________。
(3)E元素在周期表的位置是______________。
(4) 画出D的核外电子排布图_________________________________________,这样排布遵循了______________原理、____________原理和____________规则。
(5)用电子式表示B的硫化物的形成过程:______________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:CH3OH(g)+![]() O2(g)=CO2(g)+2H2(g) ΔH=﹣190kJ/mol。下列说法正确的是
O2(g)=CO2(g)+2H2(g) ΔH=﹣190kJ/mol。下列说法正确的是
A.CH3OH的燃烧热为190kJ/mol
B.该反应说明CH3OH比H2稳定
C.反应中的能量变化与反应体系的温度和压强无关
D.CO2(g)+2H2(g)=CH3OH(g)+![]() O2(g) ΔH=+190kJ/mol
O2(g) ΔH=+190kJ/mol
查看答案和解析>>
科目: 来源: 题型:
【题目】在101 kPa时,氢气在1.0 mol氧气中完全燃烧,生成2.0 mol液态水,放出571.6 kJ的热量,氢气的标准燃烧热ΔH为____,表示氢气标准燃烧热的热化学方程式为________
查看答案和解析>>
科目: 来源: 题型:
【题目】表为周期表的一部分,其中的编号代表对应的元素。

请回答下列问题:
(1)表中属于d区的元素是________(填编号)。
(2)写出元素⑧的基态原子的电子排布式__________________________。
(3)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的成对电子为________对。
(4)元素④的氢化物的分子构型为________,中心原子的杂化形式为________。
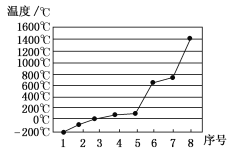
(5)第三周期8种元素按单质熔点高低的顺序如图,其中序号“8”代表________(填元素符号);其中电负性最大的是________(填图中的序号)。
查看答案和解析>>
科目: 来源: 题型:
【题目】钴是人体不可或缺的微量元素之一。Co、Al、O形成的一种化合物钴蓝晶体结构如图所示。
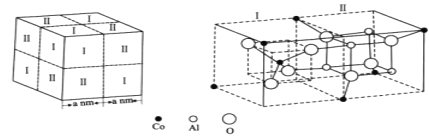
基态Co原子的价电子排布图为___。该立方晶胞由4个I型和4个Ⅱ型小立方体构成,其化学式为___,NA为阿伏加德罗常数的值,钴蓝晶体的密度为___g·cm-3(列计算式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室用苯和浓硝酸、浓硫酸发生反应制取硝基苯的装置如下图所示。请回答下列问题:
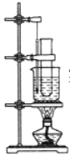
(1)反应需在55~60 ℃的温度下进行,图中给反应物加热的方法是________,
(2)在配制混合酸时先加_____________后加_____________;
(3)该反应的化学方程式是_____________________; 反应类型为:_______;
(4)反应完毕后,除去混合酸,所得粗产品用如下操作精制:①蒸馏 ②水洗 ③用干燥剂干燥 ④用10% NaOH溶液洗 ⑤水洗 正确的操作顺序是________。
A.①②③④⑤ B.②④⑤③①
C.④②③①⑤ D.②④①⑤③
查看答案和解析>>
科目: 来源: 题型:
【题目】铁元素是最重要的金属元素之一,其不仅是各种钢材的主要成分,很多含铁化合物也具有重要意义。
(1)按照电子排布,可把元素周期表中的元素划分成五个区,铁元素属于____区。
(2)Fe-Cr-Al合金可作为汽车尾气催化剂的载体,汽车尾气催化剂可将NO2还原为无毒害的气体,防止HNO3型酸雨的形成,NO2的空间构型为____。HNO3的酸性强于HNO2的原因为___。
(3)金属铁晶体中铁原子采用体心立方堆积,该铁晶体的空间利用率为___(用含π的式子表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com