
科目: 来源: 题型:
【题目】相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-92.6 kJ·mol-1。实验测得起始、平衡时的有关数据如下表所示:
2NH3(g) ΔH=-92.6 kJ·mol-1。实验测得起始、平衡时的有关数据如下表所示:
容器编号 | 起始时各物质的物质的量/mol | 达平衡时体系能量的变化 | ||
N2 | H2 | NH3 | ||
① | 1 | 3 | 0 | 放出热量:23.15 kJ |
② | 0.9 | 2.7 | 0.2 | 放出热量:Q |
下列叙述错误的是
A.容器①、②中反应的平衡常数相等
B.平衡时,两个容器中NH3的体积分数均为![]()
C.容器②中达平衡时放出的热量Q=23.15 kJ
D.若容器①的体积为0.5 L,则平衡时放出的热量小于23.15 kJ
查看答案和解析>>
科目: 来源: 题型:
【题目】氮和硫的化合物在工农业生产、生活中具有重要应用。请回答下列问题:
(1)航天领域中常用N2H4作为火箭发射的助燃剂。N2H4与氨气相似,是一种碱性气体,易溶于水,生成弱碱N2H4·H2O。用电离方程式表示N2H4·H2O显碱性的原因是:____________________________________________。
(2)在恒温条件下,1 mol NO2和足量C发生反应2NO2(g)+2C(s)![]() N2(g)+2CO2(g),测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
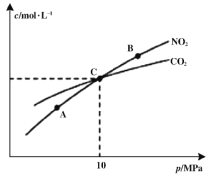
①A、B两点的浓度平衡常数关系:Kc(A) ___________Kc(B)(填“<”或“>”或“=”)
②A、B、C三点中NO2的转化率最高的是___________(填“A”或“B”或“C”)点。
③计算C点时该反应的压强平衡常数Kp=___________MPa(Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)已知:亚硝酸(HNO2)性质和硝酸类似,但它是一种弱酸。常温下亚硝酸的电离平衡常数Ka=5.1×10-4;H2CO3的Ka1=4.2×10-7,Ka2=5.61×10-11。在常温下向含有2mol碳酸钠的溶液中加入1mol的HNO2后,则溶液中CO32-、HCO3-和NO2-的离子浓度由大到小的顺序是______________________。
(4)已知:常温下甲胺(CH3NH2)的电离常数为Kb,且pKb=-lgKb=3.4水溶液中有CH3NH2+H2OCH3NH3++OH-。常温下向CH3NH2溶液滴加稀硫酸至c(CH3NH2)=c(CH3NH3+)时,则溶液pH=_______。
(5)一种煤炭脱硫技术可以把硫元素以CaSO4的形成固定下来,但产生的CO又会与CaSO4发生化学反应,相关的热化学方程式如下:
①CaSO4(s)+CO(g) CaO(s)+SO2(g)+CO2(g) △H=+210.5kJ· mol-1
②CaSO4(s)+4CO(g) CaS(s)+ 4CO2(g) △H=-189.2 kJ· mol-1
反应CaO(s)+3CO(g)+SO2(g) CaS(s)+3CO2(g) △H=___________ kJ· mol-1
查看答案和解析>>
科目: 来源: 题型:
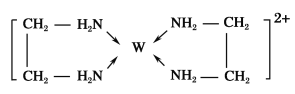
【题目】X、Y、Z、V、W为五种前四周期元素,其中X是短周期(除稀有气体外)原子半径最大的元素;Y与X同周期,其最高价氧化物对应的水化物呈两性;Z原子基态时2p原子轨道上有3个未成对的电子;V原子的核外电子排布式为1s22s22p63s2;W的原子序数为29,W的离子能与乙二胺(H2N—CH2—CH2—NH2)形成配离子:
回答下列问题:
(1)W原子的核外价电子排布式为___,该配离子中含有的化学键类型有___(填字母)。
a.配位键 b.极性键 c.离子键 d.非极性键
(2)元素X、Y、V第一电离能由大到小的顺序是___(用元素符号表示)。
(3)Z的氢化物的空间构型是___;该氢化物的沸点比甲烷的高,其主要原因是___;Z的另一种氢化物Z2H4分子中Z原子轨道的杂化类型是___。
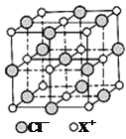
(4)X和Cl元素构成的化合物XCl,XCl的晶胞结构如图所示,晶体中X+的配位数是___。每个X+周围与其紧邻的Cl-围成的几何图形为___。若W晶体中一个晶胞的边长为apm,则W晶体的密度为___g/cm3(写出含a的表达式,用NA表示阿伏加德罗常数)。
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,用浓度为0.1000mol·L-1的NaOH溶液滴定20.00mL浓度为0.1000mo l·L-1的某酸HX,滴定曲线如图所示。下列说法正确的是( )

A. HX的电离常数Ka的数量级为10-10
B. P点溶液中微粒浓度大小为:c(Na+)>c(HX)>c(X-)>c(OH-)>c(H+)
C. 滴定过程中可选用的指示剂有甲基橙和酚酞
D. A点到B点过程中,水电离出的c(H+)×c(OH-)先增大,后不变
查看答案和解析>>
科目: 来源: 题型:
【题目】已知 25℃下时,NH3·H2O kb=1.77×10-5;H2CO3 ka1=4.30×10-7、ka2=5.61×10-11。 25℃时有关NH4HCO3溶液的说法中正确的是
A. 呈弱酸性
B. c(OH-)+c(NH3·H2O)=c(H+)+c(H2CO3)
C. 滴入NaOH 溶液发生反应:NH4++OH-=NH3·H2O和HCO3-+OH-=H2O+CO32-
D. 滴入NaOH溶液,则![]() 增大
增大
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,在密闭容器中发生可逆反应的平衡常数K=![]() 。当反应达到平衡时,n(A)∶n(B)∶n(C)=2∶2∶1。若保持温度不变,以2∶2∶1的物质的量之比再充入A、B、C,则
。当反应达到平衡时,n(A)∶n(B)∶n(C)=2∶2∶1。若保持温度不变,以2∶2∶1的物质的量之比再充入A、B、C,则
A.K值增大B.达到新平衡后,C的体积分数增大
C.平衡不移动D.达到新平衡后,vA比原平衡减慢
查看答案和解析>>
科目: 来源: 题型:
【题目】合成氨反应过程中的能量变化如图所示,下列说法正确的是
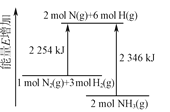
A.NH3的能量较低,比N2、H2更稳定
B.2NH3(g)→2N(g)+6H(g)-2346 kJ
C.N2(g)+3H2(g)![]() 2NH3(g)-92 kJ
2NH3(g)-92 kJ
D.加入催化剂,可以减小反应的热效应
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A、B、C、D、E、F、G都是元素周期表中短周期主族元素,它们的原子序数依次增大。A是元素周期表中原子半径最小的元素,D3B中阴、阳离子具有相同的电子层结构,B原子最外电子层的p能级处于半满状态,C原子最外层的p能级电子数是s能级电子数的2倍,C、F处于同一主族,E最外层电子数比最内层多1。回答下列问题:
(1)E元素基态原子的电子排布式为___。
(2)用电子排布图表示F元素原子的价电子排布:____。
(3)F、G元素对应的最高价含氧酸中酸性较强的是___(填化学式)。
(4)离子半径:D+___(填“<”“>”或“=”,下同)B3-,第一电离能:B___C,电负性:C__F。
(5)A、C形成的一种绿色氧化剂X有广泛应用,X分子中A、C原子个数比为1∶1,X的电子式为___。试写出Cu、稀硫酸与X反应制备硫酸铜的离子方程式:__。
(6)写出E的单质与D的最高价氧化物对应的水化物反应的化学方程式:____。
查看答案和解析>>
科目: 来源: 题型:
【题目】反应8NH3+3Cl2→N2+6NH4Cl的相关描述中正确的是
A.N2的电子式是 ![]()
B.反应物和生成物的化学键类型相同
C.每生成11.2 L N2,转移电子数为3 NA
D.还原剂与还原产物的物质的量之比是1∶3
查看答案和解析>>
科目: 来源: 题型:
【题目】利用生活中或实验室中的常用物品,根据氧化还原反应知识和电化学知识,自己动手设计一个原电池.请填写下列空白:
(1)实验原理:Fe+2H+=Fe2++H2↑
(2)实验用品:电极(__、__)、稀硫酸、__、__耳机(或电流计).
(3)①按如图所示装置连接好实验仪器,这时可以听见耳机发出“嚓嚓……”的声音。其原因是在原电池中化学能转化为__,在耳机中__又转化为声波这种能量。
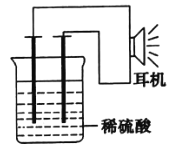
②在该原电池内中,Fe在___极发生了___反应,H+在___极发生了___反应。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com