
科目: 来源: 题型:
【题目】研究金属与硝酸的反应,实验如下。
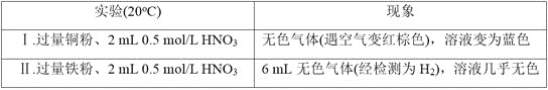
(1)Ⅰ中的无色气体是_________。
(2)Ⅱ中生成H2的离子方程式是______________。
(3)研究Ⅱ中的氧化剂
①甲同学认为该浓度的硝酸中H+的氧化性大于![]() ,所以
,所以![]() 没有发生反应。乙同学依据Ⅰ和Ⅱ证明了甲的说法不正确,其实验证据是____________。
没有发生反应。乙同学依据Ⅰ和Ⅱ证明了甲的说法不正确,其实验证据是____________。
②乙同学通过分析,推测出![]() 也能被还原,依据是_____________,进而他通过实验证实该溶液中含有
也能被还原,依据是_____________,进而他通过实验证实该溶液中含有![]() ,其实验操作是____________。
,其实验操作是____________。
(4)根据实验,金属与硝酸反应时,影响硝酸还原产物不同的因素有__________;试推测还可能有哪些因素影响_________(列举1条)。
查看答案和解析>>
科目: 来源: 题型:
【题目】为探究某不溶性固体X(仅含四种元素)的成分,设计并完成了如下实验:
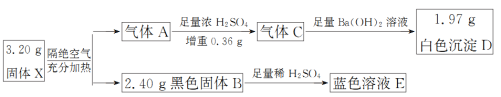
已知气体A是混合物,气体C是纯净物且无色无味。请回答:
(1)气体C分子的结构式为______,黑色固体B的化学式为______。
(2)该流程中X隔绝空气加热分解的化学方程式为_________。
(3)向蓝色溶液E中加入KI溶液,有白色沉淀生成,溶液的颜色则由蓝色变为深黄色,经分析白色沉淀是CuI,写出该反应的离子方程式___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】将4molA和2molB放入2L密闭容器中发生反应2A(g)+B(g)![]() 2C(g) △H<0
2C(g) △H<0
,4s后反应达到平衡状态,此时测得C的浓度为0.6mol/L.下列说法正确的是( )
A.若不断增加A的质量,可使反应放出热量的数值达到2︱ΔH︱
B.4 s内,υ(B)=0.075 mol/(L ·s)
C.达到平衡状态后,若只升高温度,则C的物质的量浓度增大
D.达到平衡状态后,若温度不变,缩小容器的体积,则A的转化率降低
查看答案和解析>>
科目: 来源: 题型:
【题目】T℃下,三种硫酸盐MSO4(M:Pb2+、Ba2+、Sr2+)的沉淀溶解平衡曲线如图所示。已知p(M)=-lgc(M),p(SO42-)=-lgc(SO42-)。下列说法正确的是( )
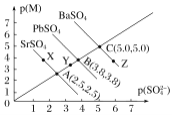
A.溶度积:BaSO4>PbSO4>SrSO4
B.Y点对应的SrSO4是不饱和溶液,能继续溶解SrSO4
C.Z点对应的溶液中c(Ba2+)>c(SO42-),c(Ba2+)·c(SO42-)等于1×10-25
D.BaSO4不可能转化成PbSO4
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应在常温下均为非自发反应,在高温下仍为非自发的是
A. 2Ag2O(s)=4Ag(s)+O2(g)
B. 2Fe2O3(s)+3C(s)=Fe(s)+3CO2(g)
C. N2O4(g)=2NO2(g)
D. 6C(s)+6H2O(l)=C6H12O6(s)
查看答案和解析>>
科目: 来源: 题型:
【题目】2009年10月1日,我国成功举办国庆六十年阅兵活动。其中阅兵仪式上9辆电动车与混合动力车等新能源车辆的亮相,展示了综合国力、国防科技发展水平。同时也说明能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ: CO(g) + 2H2(g)![]() CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应Ⅱ: CO2(g) + 3H2(g)![]() CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2
①上述反应符合“原子经济”原则的是 _____(填“Ⅰ”或“Ⅱ”)。
②下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
由表中数据判断ΔH1 0 (填“>”、“=”或“<”)。
③某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)= 0.2 mol/L,则CO的转化率为 ,此时的温度为 (从上表中选择)。
(2)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH1=-1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH2=-566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH3=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
(3)某实验小组依据甲醇燃烧的反应原理,
①设计如图所示的电池装置。该电池正极的电极反应为 。

②工作一段时间后,测得溶液的pH减小,该电池总反应的化学方程式为
。
查看答案和解析>>
科目: 来源: 题型:
【题目】将一定质量的铜粉加入到 100 mL 某浓度的稀硝酸中,充分反应后,容器中剩有 m1g 铜粉,此时共收集到 NO 气体 448mL(标准状况).然后向上述混合物中加入足量稀硫酸至不再反应为止,容器仍剩有铜粉 m2g,则(m1-m2)为( )
A.2.88B.5.76C.7.2D.11.52
查看答案和解析>>
科目: 来源: 题型:
【题目】某稀硫酸和稀硝酸的混合溶液 200mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解9.6 g。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示(已知硝酸只被还原 为 NO 气体)。下列分析或结果错误的是( )
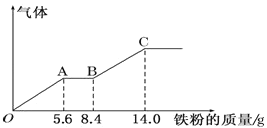
A.第二份溶液中最终溶质为FeSO4
B.OA 段产生的是 NO,AB 段的反应为 Fe+2Fe3+═3Fe2+,BC 段产生氢气
C.原混合酸中HNO3 的物质的量为 0.8mol
D.H2SO4 浓度为 2.5molL-1
查看答案和解析>>
科目: 来源: 题型:
【题目】下列对化学平衡移动的分析中,不正确的是
①已达平衡的反应C(s)+H2O(g)![]() CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动
CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动
②已达平衡的反应N2(g)+3H2(g)![]() 2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高
2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高
③有气体参加的反应平衡时,若减小反应器容积时,平衡一定向气体体积增大的方向移动
④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动
A. ①④B. ①②③C. ②③④D. ①②③④
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物M(C16H14O2)是一种香料,工业上利用烃A和甲苯为主要原料,按下列路线合成:
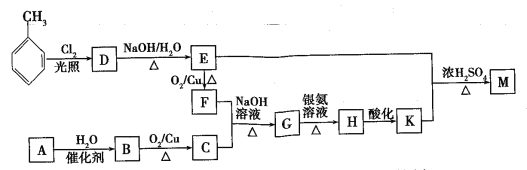
已知:①气态烃A在标准状况下的密度是1.25g/L,能作为果实催熟剂;②醛在碱性溶液中能发生羟醛缩合反应,再脱水生成不饱和醛:RCH2CHO+ 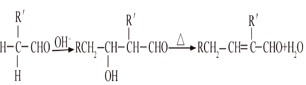 。请回答下列问题:
。请回答下列问题:
(1)K的名称是___________;G中含有的官能团名称是______________。
(2)写出D→E的化学方程式____________________________________。
(3)A→B的反应类型是_______;
(4)同时满足下列三个条件的K的同分异构体有_____种(不考虑立体异构)。①遇FeCl3溶液发生显色反应;②能发生银镜反应;③除苯环以外不再含有其他环状结构。其中核磁共振氢谱为五组峰的结构简式为____。
(5)以乙醇为起始原料,选用必要的无机试剂设计合成1-丁烯的路线。(用结构简式表示有机物,箭头上注明试剂和反应条件)____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com