
科目: 来源: 题型:
【题目】在一定温度下,将气体X和气体Y各![]() 充入10L恒容密闭容器中,发生反应
充入10L恒容密闭容器中,发生反应![]() ,一段时间后达到平衡。反应过程中测定的数据如表:下列说法不正确的是
,一段时间后达到平衡。反应过程中测定的数据如表:下列说法不正确的是
| 2 | 4 | 7 | 9 |
|
|
|
|
|
A.反应前2min的平均速率![]()
B.其他条件不变,升高温度,反应达到新平衡前![]() 正
正![]() 逆
逆![]()
C.该温度下此反应的平衡常数![]()
D.其他条件不变,再充入![]() ,平衡时X的体积分数增大
,平衡时X的体积分数增大
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A.麦芽糖水解的产物互为同分异构体
B.甘氨酸与苯丙氨酸互为同系物
C.CH3CH2OOCCOOCH2CH3 的名称是乙二酸乙二酯
D.天然油脂大多是由混合甘油酯分子组成的混合物
查看答案和解析>>
科目: 来源: 题型:
【题目】设阿伏加德罗常数的值为NA,下列说法中正确的是
A.常温常压下,15g的—12CH3中含有中子数6NA
B.46 g乙醇和46 g甲酸含有的氧原子数均为NA
C.32g甲醇中含有C—H键的数目为4NA
D.标准状况下,1L甲醛完全燃烧所生成的气态产物的分子数为![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室用Cl2与KOH溶液反应制备KClO溶液,其装置如下图所示。以KClO溶液及废铁屑等为原料,可制备高效水处理剂聚合硫酸铁![]() 。
。
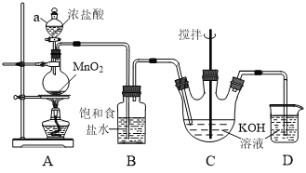
已知:C中反应是放热反应
(1)装置A中仪器a的名称是______;装置B的作用是_______。
(2)Cl2和KOH在较高温度下反应生成KClO3,在不改变KOH溶液的浓度和体积的条件下,控制反应在0℃~5℃进行,实验中可采取的措施是_______(回答一点即可)。
(3)装置D发生反应的离子方程式为______。
(4)聚合硫酸铁![]() (其中Fe元素为+3价)的组成可通过下列实验测定:
(其中Fe元素为+3价)的组成可通过下列实验测定:
①称取一定质量的聚合硫酸铁溶于稀盐酸中,往所得溶液中滴加BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体11.65 g;
②另称取与①等质量的聚合硫酸铁溶于稀硫酸中,加入足量铜粉,充分反应后过滤、洗涤,将滤液和洗液合并配成250.00 mL溶液B;
③准确量取25.00 mL溶液B,用0.1000 mol·L-1的KMnO4溶液滴定至终点,消耗KMnO4溶液8.00 mL。该步反应为:![]() 。通过计算确定该聚合硫酸铁的化学式(写出计算过程)。______。
。通过计算确定该聚合硫酸铁的化学式(写出计算过程)。______。
查看答案和解析>>
科目: 来源: 题型:
【题目】现代人追求“低碳生活” ,二氧化碳的回收并利用是环保领域研究的热点和重点。试分析并回答:
(1)有一最新美国科学家的研究成果,利用金属钛和某些装置等,模仿太阳的蓝色波长,使CO2慢慢发生人工“光合作用” 后,被还原成太阳能燃料——甲酸等,该化学方程式是_____________________________;
(2)另有一种用CO2生产甲醇燃料的方法:
CO2+3H2=CH3OH+H2O。已知298 K和101 kPa条件下:
CO2(g)+3H2(g)=CH3OH(g)+H2O(l) ΔH=-a kJ·mol-1;
2H2(g)+O2(g)=2H2O(l) ΔH=-b kJ·mol-1;
CH3OH(g)=CH3OH(l) ΔH=-c kJ·mol-1,
则CH3OH(l)的标准燃烧热ΔH=________。
(3)工业上合成尿素的反应如下:
2NH3(g)+CO2(g)=CO(NH2)2(l)+H2O(l) ΔH<0,某实验小组模拟工业上合成尿素的条件,在恒定温度下,将氨气和二氧化碳按2∶1的物质的量之比充入一体积为10 L的密闭容器中(假设容器体积不变,生成物的体积忽略不计),经20 min达到平衡,各物质浓度的变化曲线如图所示。
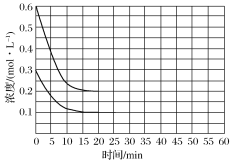
①为提高尿素的产率,下列可以采取的措施有________;
A.缩小反应容器的容积
B.升高温度
C.平衡体系中分离出部分CO(NH2)2
D.使用合适的催化剂
②若保持平衡的温度和压强不变,再向容器中充入3 mol的氨气,则此时v正________v逆(填“>”“=”或“<”),判断理由_____________________________;
③若保持平衡的温度和体积不变,25 min时再向容器中充入2 mol氨气和1 mol二氧化碳,在40 min时重新达到平衡,请在上图中画出25~50 min内氨气的浓度变化曲线________________。
(4)多孔Al2O3薄膜可作为催化剂载体、模板合成纳米材料等用途。现以高纯铝片作为阳极,不锈钢作为阴极,一定溶度的磷酸溶液作为电解质进行电解,即可初步制取多孔Al2O3膜。请写出该制取过程的阳极电极反应:__________________________________________。
(5)要实现CO2直接加H2合成汽油,关键是_____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】利用废蚀刻液(含FeCl2、CuCl2及FeCl3)制备碱性蚀刻液[Cu(NH3)4Cl2溶液]和FeCl36H2O的主要步骤:用H2O2氧化废蚀刻液,制备氨气,制备碱性蚀刻液[CuCl2+4NH3=Cu(NH3)4Cl2]、固液分离,用盐酸溶解沉淀并制备FeCl36H2O。下列实验原理和装置不能达到实验目的的是( )
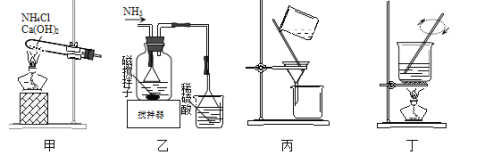
A.用装置甲制备NH3B.用装置乙制备Cu(NH3)4Cl2并沉铁
C.用装置丙分离Cu(NH3)4Cl2溶液和Fe(OH)3D.用装置丁将FeCl3溶液蒸干制备FeCl36H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上用CO与H2合成甲醇,CO(g)+2H2(s)![]() CH3OH(g) △H=—90.8kJ/mol。300℃时,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下
CH3OH(g) △H=—90.8kJ/mol。300℃时,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下
容量 | 甲 | 乙 | 丙 | |
反应物投入量 | 1 molCO、2molH2 | 1mol CH3OH | 2mol CH3OH | |
平衡时数据 | CH3OH的浓度(mol/L) | c1 | c2 | c3 |
反应的能量变化 | a kJ | b kJ | c kJ | |
体系压强(Pa) | P1 | P2 | P3 | |
反应物转化率 | a1 | a2 | a3 | |
下列说法正确的是
A.2c1>c3B.a+b<90.8C.2P2<P3D.a1+a3<1
查看答案和解析>>
科目: 来源: 题型:
【题目】以含锂电解铝废渣(主要成分为LiF、AlF3、NaF,少量CaO等)为原料,生产碳酸锂的工艺流程如下:(已知:常温下,LiOH可溶于水,Li2CO3微溶于水)
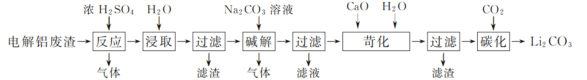
(1)含锂电解铝废渣与浓硫酸在200~400 ℃条件下反应2 h,加水浸取后过滤,得到的滤渣主要成分是________(填化学式)。
(2)流程中浸取后的过滤操作需要趁热在恒温装置中进行,否则会导致Li2SO4的收率下降,原因是________。(已知部分物质的溶解度数据见下表)
温度/℃ | Li2SO4/g | Al2(SO4)3/g | Na2SO4/g |
0 | 36.1 | 31.2 | 4.9 |
10 | 35.4 | 33.5 | 9.1 |
20 | 34.8 | 36.5 | 19.5 |
30 | 34.3 | 40.4 | 40.8 |
40 | 33.9 | 45.7 | 48.8 |
(3)40℃下进行碱解反应,得到粗碳酸锂与氢氧化铝的混合滤渣,生成氢氧化铝的离子方程式为________。
(4)苛化过程中加入的氧化钙将不溶性的碳酸锂转化成氢氧化锂溶液。若氧化钙过量,则可能会造成________。
(5)碳化反应中,CO2的吸收采用了气、液逆流的方式,这样做的优点是________。整个工艺流程中可以循环利用的物质有________。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A. 含大量Fe3+的溶液中:Na+、Mg2+、SO42-、SCN-
B. ![]() =106的溶液中:NH4+、K+、AlO2-、NO3-
=106的溶液中:NH4+、K+、AlO2-、NO3-
C. 能使甲基橙变红的溶液中:Cu2+、Mg2+、SO42-、Cl-
D. 1.0mol·L-1的KNO3溶液中:Fe2+、H+、Cl-、I-
查看答案和解析>>
科目: 来源: 题型:
【题目】(改编)在稀硫酸与锌反应制取氢气的实验中,探究加入硫酸铜溶液的量对氢气生成速率的影响。实验中Zn粒过量且颗粒大小相同,饱和硫酸铜溶液用量0~4.0mL,保持溶液总体积为100.0mL,记录获得相同体积(336mL)的气体所需时间,实验结果如图所示(气体体积均转化为标况下)。据图分析,下列说法不正确的是

A.饱和硫酸铜溶液用量过多不利于更快收集氢气
B.a、c两点对应的氢气生成速率相等
C.b点对应的反应速率为v(H2SO4) = 1.0×10-3 mol·L-1·s-1
D.d点没有构成原电池,反应速率减慢
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com