
科目: 来源: 题型:
【题目】下列说法正确的是( )
A.氯乙烯、聚乙烯均可使酸性高锰钾溶液褪色
B.煤的干馏、石油的分馏、油脂硬化均属于物理变化
C.![]() 与
与![]() 互为同分异构体,
互为同分异构体,![]() 谱显示两者均有三种不同的氢原子且三种氢原子的比例相同,故不能用
谱显示两者均有三种不同的氢原子且三种氢原子的比例相同,故不能用![]() 来鉴别
来鉴别
D.按系统命名法,化合物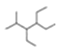 的名称为
的名称为![]() 甲基
甲基![]() ,
,![]() 二乙基己烷
二乙基己烷
查看答案和解析>>
科目: 来源: 题型:
【题目】对工业废气进行脱硝有多种方法。
(1)用活性炭还原法处理氮氧化物的反应为C(s)+2NO(g)![]() N2(g)+CO2(g)。一定条件下按下表所示条件向体积固定的容器中充入物质发生该反应。
N2(g)+CO2(g)。一定条件下按下表所示条件向体积固定的容器中充入物质发生该反应。
容器 | 温度 | 体积 | C(s) | NO(g) | N2(g) | CO2(g) |
甲 | 600℃ | V L | 1mol | 2mol | 0 | 0 |
乙 | 600℃ | V L | 0 | 0 | 2mol | 2mol |
①下列能说明甲容器中反应达到平衡状态的是_______。
a.容器的压强保持不变 b.v(NO)正=2v(CO2)逆
c.混合气体的密度保持不变 d.NO、N2、CO2的物质的量之比为2∶1∶1
②关于平衡时的甲、乙两容器,下列说法一定正确的是_______。
a.p(甲)=p(乙) b.c(NO)甲=c(CO2)乙
c.2c(CO2)甲=c(N2)乙 d.体积分数φ(CO2)甲=φ(N2)乙
(2)氮氧化物与悬浮在大气中的海盐粒子相互作用生成亚硝酰氯(ClNO),涉及反应如下:4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g) K1 ;2NO2(g)+NaCl(s)
2NaNO3(s)+2NO(g)+Cl2(g) K1 ;2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) K2;2NO(g)+Cl2(g)
NaNO3(s)+ClNO(g) K2;2NO(g)+Cl2(g)![]() 2ClNO(g) K3;则K1、K2 、K3之间的关系为K3=_______
2ClNO(g) K3;则K1、K2 、K3之间的关系为K3=_______
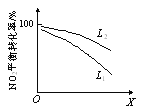
(3)利用O3进行如下脱硝反应:2NO2(g)+O3(g)![]() N2O5(g)+O2(g) ΔH<0。其他条件一定时,NO2(g)的平衡转化率随温度和压强的变化情况如下图甲所示。X表示_______(填“压强”或“温度”),L1_______L2(填“<”或“>”)。
N2O5(g)+O2(g) ΔH<0。其他条件一定时,NO2(g)的平衡转化率随温度和压强的变化情况如下图甲所示。X表示_______(填“压强”或“温度”),L1_______L2(填“<”或“>”)。
(4)用稀硝酸吸收NOx进行脱硝,得到HNO3和HNO2(弱酸)的混合溶液,电解该混合溶液可获得较浓的硝酸。写出电解时阳极的电极反应式:_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】钴元素是三元锂离子电池阳极材料的重要成分。请回答下列问题:
(1)钴元素在周期表中的位置是______________。
(2)已知第四电离能大小:I4(Fe)> I4 (Co),从原子结构的角度分析可能的原因是__________。
(3)Cu2Cl22CO2H2O是一种配合物,其结构如图所示:
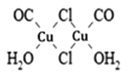
①该配合物中氯原子的杂化方式为______。
②该配合物中,CO作配体时配位原子是C而不是O的原因是______。
(4)某种铀氮化物的晶体结构是NaCl型。NaCl的Bom-Haber循环如图所示。已知:元素的一个气态原子获得电子成为气态阴离子时所放出的能量称为电子亲和能。下列有关说法正确的是__(填标号)。

a、Cl-Cl键的键能为119.6kJ/mol b、Na的第一电离能为603.4kJ/mol
c、NaCl的晶格能为785.6kJ/mol d、Cl的第一电子亲和能为348.3kJ/mol
(5)碲化锌晶体有两种结构,其中一种晶胞结构如图:

若与Zn距离最近的Te原子间距为a pm,则晶体密度为__________g/cm3。
查看答案和解析>>
科目: 来源: 题型:
【题目】某实验兴趣小组按下图装置实验后,所记录内容合理的是( )
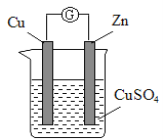
实验 记录 | ① Cu为正极,Zn为负极; ② Zn质量减少,Cu质量增加; ③ SO ④ 电子流方向是:由Zn经导线流入Cu片; ⑤ Zn电极发生还原反应; ⑥ 正极反应式:Cu2+ + 2e- = Cu |
A.②③④ B.①②④⑥ C.①②④⑤ D.②③⑤⑥
查看答案和解析>>
科目: 来源: 题型:
【题目】某含有![]() 的澄清溶液中,可能还含有
的澄清溶液中,可能还含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 六种离子中的几种。将该溶液进行如下实验:
六种离子中的几种。将该溶液进行如下实验:![]() 滴加适量新制氯水,有气泡生成,溶液变黄色;
滴加适量新制氯水,有气泡生成,溶液变黄色;![]() 向“
向“![]() ”中所得溶液中加入
”中所得溶液中加入![]() 溶液,无沉淀生成;
溶液,无沉淀生成;![]() 向“
向“![]() ”中所得溶液中加入淀粉溶液,不显蓝色。依据上述实验事实推断该溶液中
”中所得溶液中加入淀粉溶液,不显蓝色。依据上述实验事实推断该溶液中![]()
A.一定存在![]() 、
、![]() 、
、![]() B.无法确定
B.无法确定![]() 的存在
的存在
C.一定不存在![]() 、
、![]() 、
、![]() D.一定存在
D.一定存在![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)反应Fe(s)+CO2(g)![]() FeO(s)+CO(g) ΔH1,平衡常数为K1
FeO(s)+CO(g) ΔH1,平衡常数为K1
反应Fe(s)+H2O(g)![]() FeO(s)+H2(g) ΔH2,平衡常数为K2在不同温度时K1、K2的值如下表:
FeO(s)+H2(g) ΔH2,平衡常数为K2在不同温度时K1、K2的值如下表:
700 ℃ | 900 ℃ | |
K1 | 1.47 | 2.15 |
K2 | 2.38 | 1.67 |
反应CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH,平衡常数K,则ΔH=___________(用ΔH1和ΔH2表示),K=___________(用K1和K2表示),且由上述计算可知,反应CO2(g)+H2(g)
CO(g)+H2O(g) ΔH,平衡常数K,则ΔH=___________(用ΔH1和ΔH2表示),K=___________(用K1和K2表示),且由上述计算可知,反应CO2(g)+H2(g)![]() CO(g)+H2O(g)是________反应(填“吸热”或“放热”)。
CO(g)+H2O(g)是________反应(填“吸热”或“放热”)。
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g)![]() FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示:
FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示:
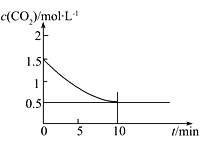
①该条件下反应的平衡常数为___________;若铁粉足量,CO2的起始浓度为2.0 mol·L-1,则平衡时CO2的浓度为____________mol·L-1。
②下列措施中能使平衡时![]() 增大的是__________(填序号) 。
增大的是__________(填序号) 。
A.升高温度 B.增大压强 C.再充入一定量的CO2 D.再加入一定量铁粉
③一定温度下,在一个固定容积的密闭容器中发生上述反应,下列能判断该反应达到化学平衡状态的是________(填字母)。
a. 容器中的压强不变 b.气体的密度不再改变
c. v正(CO2)=v逆(CO) d. c(CO2)=c(CO)
e. 容器内气体总物质的量不变
查看答案和解析>>
科目: 来源: 题型:
【题目】现有下列各化合物:
A.CH3CH2CH2CHO与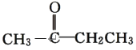
B.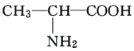 与
与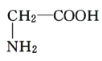
C. ![]() 与
与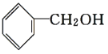
D.CH3CH≡CH与CH2=CH—CH=CH2
E. 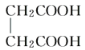 与
与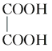
F.戊烯与环戊烷
(1)上述各组化合物中属于同系物的是________,属于同分异构体的是________(填字母)。
(2)上述A中两化合物的含氧官能团是__________和 __________(写名称)。
(3)根据官能团的特点可将C中两种化合物划分为________类和________类。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各反应对应的离子方程式正确的是
A.向100 mL 0.12 mol·L1的Ba(OH)2溶液中通入0.02 mol CO2: Ba2++3OH+2CO2=![]() +BaCO3↓+H2O
+BaCO3↓+H2O
B.向Ca(OH)2溶液中加入过量的NaHCO3溶液:Ca2++2OH+2![]() =
=![]() CaCO3↓+
CaCO3↓+![]() +2H2O
+2H2O
C.硫酸氢钠与氢氧化钡两种溶液反应后溶液恰好呈中性:H++![]() +Ba2++OH=BaSO4↓+H2O
+Ba2++OH=BaSO4↓+H2O
D.向含0.1 mol NaOH和0.2molNa2CO3的溶液中加入1L0.4 mol·L1稀盐酸:OH+![]() +3H+=CO2↑+2H2O
+3H+=CO2↑+2H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】铁系元素是人体必需的微量元素, Fe3+可以与KSCN溶液、苯酚等发生显色作用。镁元素也是人体所必需的阳离子元素之一,它能够维持核酸结构的稳定性,调节机体免疫功能,对人体抵抗新冠病毒等病毒侵袭起着重要作用。
(1)与SCN互为等电子体且为非极性分子的化学式为__________(任写一种)。
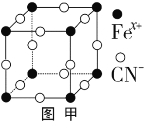
(2)普鲁士蓝俗称铁蓝,晶胞如图甲所示(K+未画出),平均每两个晶胞立方体中含有一个K+,又知该晶体中铁元素有+2价和+3价两种,则Fe3+与Fe2+的个数比为___________。
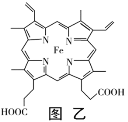
(3)血红素铁(图乙)用作铁强化剂,其吸收率比一般铁剂高3倍,在图乙中画出Fe2+与N原子间的化学键(若是配位键,需要用箭头加以表示)_____________
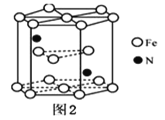
(4)某种磁性氮化铁的结构如图2所示,Fe为____________堆积,N随机排列在Fe构成的正四面体空隙中,空隙的占有率为![]() ,则该化合物的化学式为___________。 其中铁原子最近的铁原子的个数为________;氮化铁晶胞底边长为a nm,高为c nm,则这种磁性氮化铁的晶体密度为______ g·cm-3 (用含a、c和NA的计算式表示)。
,则该化合物的化学式为___________。 其中铁原子最近的铁原子的个数为________;氮化铁晶胞底边长为a nm,高为c nm,则这种磁性氮化铁的晶体密度为______ g·cm-3 (用含a、c和NA的计算式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某溶液中可能含有![]() ,某同学为了确定其组分,设计并完成了如图实验:
,某同学为了确定其组分,设计并完成了如图实验:
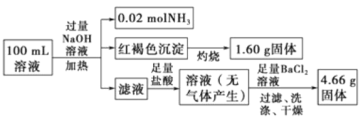
由此可推测原溶液中
A.一定存在![]() ,一定不存在
,一定不存在![]()
B.一定存在![]() ,一定不存在
,一定不存在![]()
C.![]() 至少为
至少为![]()
D.![]() 一定为
一定为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com