
科目: 来源: 题型:
【题目】燃煤烟气中含有大量的二氧化硫,进行脱硫处理可以减少环境污染,变废为宝。
(1)H2还原法是处理燃煤烟气中SO2的方法之一。已知:2H2S(g)+SO2(g)=3S(s)+2H2O(l) ΔH=a kJ·mol-1;H2S(g)=H2(g)+S(s) ΔH=b kJ·mol-1;H2O(l)=H2O(g) ΔH=c kJ·mol-1;写出SO2(g)和H2(g)反应生成S(s)和H2O(g)的热化学方程式:_______。
(2)新型纳米材料氧缺位铁酸盐(ZnFe2Ox)能使工业废气中酸性氧化物分解除去,若2 mol ZnFe2Ox与足量SO2可生成2 mol ZnFe2O4和1.0 mol S,则x=_______。
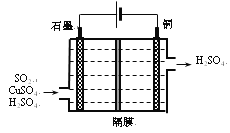
(3)一种以铜作催化剂脱硫有如下两个过程:
①在铜的作用下完成工业尾气中SO2的部分催化氧化,所发生反应为:2SO2+2n Cu+(n+1)O2+(2-2 n)H2O=2n CuSO4+(2-2n) H2SO4,吸收标准状况下11.2L SO2,被SO2还原的O2的质量为______g。
②利用如所示电化学装置吸收另一部分SO2,并完成Cu的再生。写出装置内所发生反应的离子方程式______;若用甲烷燃料电池作电源(电解质溶液呈碱性),负极的反应式为_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】在容积为1L的密闭容器中,充入1mol CO2和3mol H2,在温度500℃时发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+ H2O(g) △H<0。CH3OH的浓度随时间变化如图,下列说法不正确的是
CH3OH(g)+ H2O(g) △H<0。CH3OH的浓度随时间变化如图,下列说法不正确的是
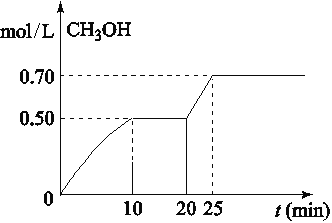
A. 从反应开始到10分钟时,H2的平均反应速率v(H2)=0.15 mol/(L·min)
B. 从20分钟到25分钟达到新的平衡,可能是增大压强
C. 其它条件不变,将温度升到800℃,再次达平衡时平衡常数减小
D. 从开始到25分钟,CO2的转化率是70%
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验符合操作要求且能达到实验目的的是( )
A.I可用于制备氢气并检验其可燃性
B.II可用于除去CO2中的HCl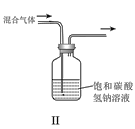
C.Ⅲ可用于配制一定物质的量浓度的NaOH溶液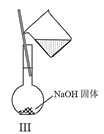
D.IV可用于制备氢氧化亚铁并长时间保存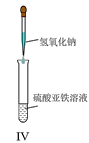
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,向20.00mL 0.1000mol·L1盐酸中滴加0.1000mol·L1 NaOH溶液,溶液的pH随NaOH溶液体积的变化如图,已知lg3=0.5,邻苯二甲酸为弱酸。下列说法不正确的是( )
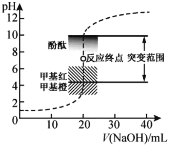
A.选择变色范围在pH突变范围内的指示剂,可减小实验误差
B.用酸式滴定管量取20.00mL 0.1000mol·L1盐酸时,酸式滴定管水洗后需用待取液润洗
C.NaOH标准溶液浓度的准确性直接影响分析结果的可靠性,因此需用邻苯二甲酸氢钠标定NaOH溶液的浓度,标定时采用甲基橙为指示剂
D.V(NaOH)=10.00mL 时,pH约为1.5
查看答案和解析>>
科目: 来源: 题型:
【题目】LiCoO2(钴酸锂)是锂离子电池的正极材料。以某海水为原料制备钴酸锂的一种流程如下:
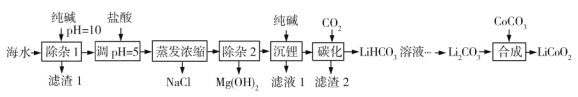
已知如下信息:
①该海水中含浓度较大的LiCl,含少量MgCl2、CaCl2、MnCl2等。
②碳酸锂的溶解度与温度关系如图所示:

③常温下,几种难溶物质的溶度积数据如下:
物质 | Li2CO3 | MgCO3 | CaCO3 | MnCO3 | Mg(OH)2 |
Ksp | 2.5×102 | 6.8×106 | 2.8×109 | 2.3×1011 | 6.0×1010 |
请回答下列问题:
(1)LiCoO2中钴的化合价为________。滤渣1主要成分有MgCO3、Mg(OH)2、CaCO3和__________(填化学式)。
(2)调节pH=5的目的是__________。
(3)“沉锂”包括过滤、洗涤等,宜用_________(填“热水”或“冷水”)洗涤Li2CO3。加入纯碱的量与锂回收率的关系如表所示:
序号 |
| 沉淀质量/g | 碳酸锂含量/% | 锂回收率/% |
① | 0.9∶1 | 10.09 | 92.36 | 77.67 |
② | 1.0∶1 | 10.97 | 90.19 | 82.46 |
③ | 1.1∶1 | 11.45 | 89.37 | 85.27 |
④ | 1.2∶1 | 12.14 | 84.82 | 85.45 |
从生产成本考虑,宜选择_______(填序号)方案投料。
(4)“除杂2”中调pH=13时c(Mg2+)=_________mol·L-1。
(5)“合成”中采用高温条件,放出一种能使澄清石灰水变浑浊的气体。写出“合成”发生反应的化学方程式________。
(6)在“合成”中制备1 mol LiCoO2转移电子的物质的量为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,11.2L酒精中含有分子的数目为0.5NA
B.常温常压下,3.2g18O2的中子数目为2NA
C.常温常压下,24g镁与足量盐酸充分反应,转移的电子数为2NA
D.常温常压下,2.24LCO和CO2混合气体中含有的碳原子数目为0.1NA
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物X是一种重要的有机合成中间体,用于制造塑料、涂料和黏合剂等高聚物。为研究X的组成与结构,进行了如下实验:
(1)有机物X的质谱图:
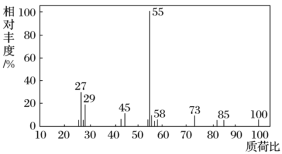
有机物X的相对分子质量是__________。
(2)将10.0 g X在足量O2中充分燃烧,并使其产物依次通过足量的无水CaCl2和KOH浓溶液,发现无水CaCl2增重7.2 g,KOH浓溶液增重22.0 g。有机物X的分子式是________________。
(3)经红外光谱测定,有机物X中含有醛基;有机物X的核磁共振氢谱图上有2个吸收峰,峰面积之比是3∶1。有机物X的结构简式是____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】甲醇、二甲醚(CH3OCH3) 既是重要的化工原料,又是可再生能源,具有开发和应用广阔前景。
(1)合成二甲醚的反应原理为2CO(g)+4H2(g)![]() CH3OCH3(g)+H2O(g)。
CH3OCH3(g)+H2O(g)。
①该反应能够自发进行的原因是_______。
②若容器的体积恒定不变,CO、H2起始通入量分别为2 mol、4 mol,充分反应后达到平衡。下列措施既可以提高反应速率又可以提高CO的转化率是_______。
a.升高温度 b.使用更高效的催化剂
c.充入He,使体系总压强增大 d.缩小体积增大压强
(2)工业上合成甲醇的化学方程式为CO(g)+2H2(g)![]() CH3OH(g) ΔH=-91 kJ·mol-1
CH3OH(g) ΔH=-91 kJ·mol-1
①已知某些化学键的键能数据如下表,则x=_______。
化学键 | C-H | H-H | C-O | C≡O | O-H |
键能/ kJ·mol-1 | a | b | c | x | d |
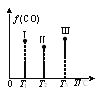
②在Ⅰ、Ⅱ、Ⅲ三个恒压容器中分别充入a mol CO和2a mol H2合成甲醇,三个容器的温度分别为T1、T2、T3。若实验测得反应均进行到t min时,三个容器中CO的体积分数如图所示,此时Ⅰ、Ⅱ、Ⅲ三个容器中一定达到化学平衡状态的是_____。若反应达到平衡,三个容器中v(CH3OH)逆最大的是____。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示装置中观察到电流计指针偏转,M棒变粗,N棒变细,指针指向M,由此判断下表中所列M、N、P物质,其中可以成立的组合是( )
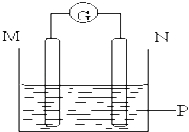
M | N | P | |
A | 锌 | 铜 | 稀硫酸溶液 |
B | 铜 | 铁 | 稀盐酸溶液 |
C | 银 | 锌 | 硝酸银溶液 |
D | 锌 | 铁 | 硝酸铁溶液 |
A.A B.B C.C D.D
查看答案和解析>>
科目: 来源: 题型:
【题目】某澄清透明溶液中,可能大量存在下列离子中的若干种:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() ,现进行如下实验:
,现进行如下实验:
![]() 用试管取少量溶液,逐滴加入稀盐酸至过量,溶液先浑浊后又变澄清,有无色气体放出。将溶液分为3份。
用试管取少量溶液,逐滴加入稀盐酸至过量,溶液先浑浊后又变澄清,有无色气体放出。将溶液分为3份。
![]() 在第1份溶液中逐滴加入NaOH溶液至过量,溶液先浑浊后又变澄清。加热,将湿润的红色石蕊试纸置于试管口,未见明显现象。
在第1份溶液中逐滴加入NaOH溶液至过量,溶液先浑浊后又变澄清。加热,将湿润的红色石蕊试纸置于试管口,未见明显现象。
![]() 在第2份溶液中加入新制的氯水和
在第2份溶液中加入新制的氯水和![]() ,振荡后静置,下层溶液显橙红色。
,振荡后静置,下层溶液显橙红色。
则下列推断正确的是![]()
A.溶液中一定有![]() 、
、![]() 、
、![]() 、
、![]()
B.溶液中一定没有![]() 、
、![]() 、
、![]() 、
、![]()
C.不能确定溶液中是否有![]() 、
、![]() 、
、![]()
D.往第3份溶液中滴加硝酸酸化的硝酸银溶液可确认是否有![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com