
科目: 来源: 题型:
【题目】用Na2FeO4溶液氧化废水中的还原性污染物M,为研究其降解效果,设计如下对比实验探究温度、浓度、pH对降解速率和效果的影响,实验测得M的浓度变化与时间的关系如图所示,下列说法不正确的是( )

实验编号 | 温度(K) | pH |
① | 298 | 1 |
② | 310 | 1 |
③ | 298 | 7 |
④ | 298 | 2 |
A.实验①在15min内M的降解速率为1.33×10-5mol·L-1·min-1
B.若其他条件相同,实验①②说明升高温度,M降解速率增大
C.若其他条件相同,实验①③证明pH越高,越不利于M的降解
D.若其他条件相同,实验①④说明M的浓度越小,降解的速率越快
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,在3个容积均为![]() 的恒容密闭容器中反应
的恒容密闭容器中反应![]() 达到平衡,下列说法正确的是
达到平衡,下列说法正确的是
容器 | 温度 | 物质的起始浓度 | 物质的平衡浓度 | ||
|
|
|
| ||
Ⅰ | 400 |
|
| 0 |
|
Ⅱ | 400 |
|
| 0 |
|
Ⅲ | 500 |
|
| 0 |
|
A. 该反应的正反应是吸热反应
B. 达到平衡时,容器Ⅰ中反应物转化率比容器Ⅱ中的小
C. 达到平衡时,容器Ⅱ中![]() 小于容器Ⅲ中
小于容器Ⅲ中![]()
D. 达到平衡时,容器Ⅲ中的正反应速率比容器Ⅰ中的小
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,在一个1L的密闭容器中,加入2molA和1molB进行如下反应:2A(g)+2B(g)![]() 3C(?)+D(?)。反应一段时间后达到平衡,测得生成0.6molC,且反应前后压强之比为15∶11(相同温度下测量),则下列说法正确的是( )
3C(?)+D(?)。反应一段时间后达到平衡,测得生成0.6molC,且反应前后压强之比为15∶11(相同温度下测量),则下列说法正确的是( )
A. 该反应的化学平衡常数K约为0.043
B. 增加C的物质的量,B的平衡转化率不变
C. 增大该体系的压强,平衡正向移动,化学平衡常数增大
D. A的平衡转化率是40%
查看答案和解析>>
科目: 来源: 题型:
【题目】从下列事实,不能用勒夏特列原理解释的是 ( )
A. 在溴水中存在如下平衡:Br2+H2O![]() HBr+HBrO当加入NaOH溶液后颜色变浅
HBr+HBrO当加入NaOH溶液后颜色变浅
B. 对![]()
![]()
![]() 平衡体系增加压强使颜色变深
平衡体系增加压强使颜色变深
C. 反应![]()
![]() CO2+NO△H<0升高温度使平衡向逆方向移动
CO2+NO△H<0升高温度使平衡向逆方向移动
D. 合成氨反应:![]()
![]() 2NH3,△H<0 为使氨的产率提高,理论上应采取低温高压的措施
2NH3,△H<0 为使氨的产率提高,理论上应采取低温高压的措施
查看答案和解析>>
科目: 来源: 题型:
【题目】根皮素J(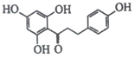 )是国外新近研究开发出来的一种新型天然美白剂,主要分布于苹果、梨等多汁水果的果皮及根皮.其中一种合成J的路线如下:
)是国外新近研究开发出来的一种新型天然美白剂,主要分布于苹果、梨等多汁水果的果皮及根皮.其中一种合成J的路线如下:
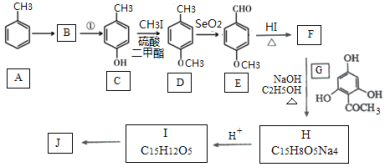
已知:
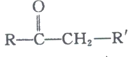 +R’’CHO
+R’’CHO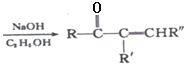 +H2O
+H2O
回答下列问题:
(1)C的化学名称是___________.E中的官能团的名称为_______________.
(2)B为溴代烃,请写出A→B的反应条件___________.
(3)写出由C生成D和由D生成E的反应类型___________、___________.
(4)F→H的化学方程式为______________________.
(5)M是E的同分异构体,同时符合下列条件的M的结构有___________种(不考虑立体异构)
①能与FeCl3溶液发生显色反应 ②能发生银镜反应
(6)设计以丙烯和1,3-丙二醛为起始原料制备![]() 的合成路线_______(无机试剂任选).
的合成路线_______(无机试剂任选).
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下在容积为2 L的密闭容器内进行某一反应,容器内气体X、气体Y的物质的量随反应时间变化的曲线如图所示。据图可知

A. 反应的化学方程式为4Y=X
B. 反应进行到t1时,Y的浓度减少了3 mol·L-1
C. 反应进行到t2时,达到平衡状态
D. 反应进行到t3时,每生成4 mol Y的同时生成1 mol X
查看答案和解析>>
科目: 来源: 题型:
【题目】镁﹣次氯酸盐燃料电池的工作原理如图,该电池反应为:Mg+ClO﹣+H2O═Mg(OH)2+Cl﹣下列有关说法正确的是( )
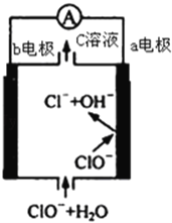
A. 电池工作时,C溶液中的溶质是MgCl2
B. 电池工作时,正极a附近的pH将不断增大
C. 负极反应式:ClO﹣﹣2e﹣+H2O═Cl﹣+2 OH﹣
D. b电极发生还原反应,每转移0.1mol电子,理论上生成0.1mol Cl﹣
查看答案和解析>>
科目: 来源: 题型:
【题目】随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%,二氧化碳(CO2)的排放量也要大幅减少。

(1)在恒温,容积为1 L容器中,硫可以发生如下转化,其反应过程和能量关系如图1所示。已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196.6 kJ·mol-1,回答下列问题:
2SO3(g) ΔH=-196.6 kJ·mol-1,回答下列问题:
①写出能表示硫的燃烧热的热化学方程式: _____________________________
②ΔH2=__________kJ·mol-1。
③在相同条件下,充入1 mol SO3和0.5 mol的O2,则达到平衡时SO3的转化率为___________;此时该反应________(填“放出”或“吸收”)________kJ的能量。
(2)中国政府承诺,到2020年单位GDP二氧化碳排放比2005年下降40%~50% 。
①CO2可转化成有机物实现碳循环。在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,测得CO2和CH3OH(g)浓度随时间变化如图2所示。从3 min到9 min,v(H2)=________mol·L-1·min-1。此条件下该反应的平衡常数为__________
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,测得CO2和CH3OH(g)浓度随时间变化如图2所示。从3 min到9 min,v(H2)=________mol·L-1·min-1。此条件下该反应的平衡常数为__________

②能说明上述反应达到平衡状态的是______(填编号)
A、反应中CO2与CH3OH的物质的量浓度之比为1∶1(即图中交叉点)
B、混合气体的密度不随时间的变化而变化
C、CO2的体积分数在混合气体中保持不变
D、单位时间内消耗3 mol H2,同时消耗1 mol H2O
③为了加快化学反应速率且使体系中气体的物质的量减少,其他条件不变时,可采取的措施有________(填编号)。
A.升高温度B.缩小容器体积C.再充入CO2气体D.使用合适的催化剂
查看答案和解析>>
科目: 来源: 题型:
【题目】(题文)高聚物I和J在生产、生活中有广泛应用,其合成路线如图:

芳香烃R的分子式为C9H10,其苯环上只有一个取代基,R与H21:1加成后产物的核磁共振氢谱中有5组峰,峰面积之比为1:2:2:1:6。
已知:R'CH=CH2![]() R'CH2CH2Br
R'CH2CH2Br
回答下列问题:
(1)芳香烃R分子的官能团是_________(填官能团符号),R的最简单同系物是_____(填化学名称)。
(2)反应②的化学方程式为__________________。
(3)③和⑦的反应类型分别属于____________、______________________。
(4)高聚物J的结构简式为________________________。
(5)反应⑥的反应条件是______________________。
(6)H与T互为同分异构体,符合下列性质特征的H分子共有________种。
①能发生银镜反应②和氯化铁溶液反应显紫色③能使溴的四氧化碳溶液褪色
(7)仿照上述合成路线,设计一条以R为主要原料制备 的合成路线(无机试剂任选):____________________________________________________。
的合成路线(无机试剂任选):____________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】剧毒物氰化钠(NaCN)固体遇水或酸生成剧毒易燃的HCN气体,同时HCN又能与水互溶,造成水污染。已知部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
电离平衡常数 (25°C) | Ka=l. 77×10-4 | Ka=5.0×10-10 | Ka1=4.3×10-7 Ka2=5. 6×10-11 |
下列选项错误的是
A.向NaCN溶液中通入少量的CO2发生的离子反应为:2CN-+H2O+CO2= 2HCN+CO32-
B.室温下,处理含CN-废水时,如用NaOH溶液调节pH至9,此时c(CN-)<c(HCN)
C.中和等体积、等pH的HCOOH溶液和HCN溶液消耗NaOH的物质的量前者小于后者
D.等体积、等物质的量浓度的HCOONa和NaCN溶液中所含离子总数前者大于后者
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com