
科目: 来源: 题型:
【题目】工业制硝酸的关键是氨的催化氧化,与硝酸工业相关的过程中产生的氮氧化物NOx(NO和NO2的混合物,假设不含N2O4)的处理与应用也是科学研究的热点。
⑴工业上可用氨催化吸收法处理NOx,反应原理为4xNH3+6NOx![]() (2x+3)N2+6xH2O。某化学兴趣小组模拟该处理过程的实验装置如图所示:
(2x+3)N2+6xH2O。某化学兴趣小组模拟该处理过程的实验装置如图所示:
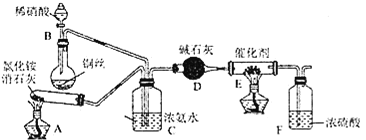
①装置A中发生反应的化学方程式为________。
②装置D中碱石灰的作用是________。
⑵工业上也常用Na2CO3溶液吸收法处理NOx(已知:NO不能与Na2CO3溶液反应)。NO+NO2+ Na2CO3 = 2 NaNO2+ CO2;
2NO2+ Na2CO3 = NaNO2+ NaNO3+ CO2。
①当NOx被Na2CO3溶液完全吸收时,x的值不可能是________![]() 填选项字母
填选项字母![]() 。
。
A.1.4 B.1.6 C.1.8
②将1 mol NOx通入Na2CO3溶液中,被完全吸收时,溶液中生成的NO3-、NO2-两种离子的物质的量随x变化关系如图所示:
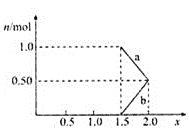
图中线段a表示________![]() 填化学式
填化学式![]() 随x值的变化关系;若用溶质质量分数为21.2%的Na2CO3溶液吸收,则需要Na2CO3溶液至少________g。
随x值的变化关系;若用溶质质量分数为21.2%的Na2CO3溶液吸收,则需要Na2CO3溶液至少________g。
![]() 用足量的Na2CO3溶液完全吸收NOx,每产生22.4 L(标准状况)CO2(全部逸出)时,吸收液质量就增加44g,则NOx中的
用足量的Na2CO3溶液完全吸收NOx,每产生22.4 L(标准状况)CO2(全部逸出)时,吸收液质量就增加44g,则NOx中的![]() ________。
________。
⑶氨催化吸收法和Na2CO3溶液吸收法处理NOx尾气的意义是________。
⑷尿素也可用于吸收处理NOx,其反应原理为NO+NO2+ H2O = 2HNO2、2HNO2+CO(NH2)2 = 3H2O + CO2↑+ 2N2↑。当混合气体中NO、NO2按上述反应中系数比时吸收效果最佳。若混合气体中V(NO):V(NO2)=5:1时,可通入一定量的空气,同温同压下,V(空气):V(NO)= ________ (空气中O2的体积含量约为20%)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述正确的是
A.常温下,将稀氨水逐滴加入稀硫酸中,当溶液的![]() 时,
时,![]()
B.两种醋酸溶液的物质的量浓度分别为![]() 和
和![]() ,pH分别为a和
,pH分别为a和![]() ,则
,则![]()
C.常温下,![]() 的NaOH溶液与
的NaOH溶液与![]() 的醋酸溶液等体积混合,滴入石蕊溶液呈红色
的醋酸溶液等体积混合,滴入石蕊溶液呈红色
D.向![]() 的氨水中加入少量硫酸铵固体,则溶液中
的氨水中加入少量硫酸铵固体,则溶液中![]() 的值增大
的值增大
查看答案和解析>>
科目: 来源: 题型:
【题目】二甲胺是农药螟铃畏的重要中间体,在一定温度压强及催化剂条件下由氨与甲醇作用而制得,反应原理为:2CH3OH(g)+NH3(g)CH3NHCH3(g)+2H2O(g)
已知:①CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(g) ΔH=-1560.8 kJ/mol kJ·mol-1
O2(g)=CO2(g)+2H2O(g) ΔH=-1560.8 kJ/mol kJ·mol-1
②2NH3(g)+![]() O2(g)=N2(g)+3H2O(g) ΔH=-236.0 kJ·mol-1
O2(g)=N2(g)+3H2O(g) ΔH=-236.0 kJ·mol-1
③CH3NHCH3(g)+![]() O2(g)=2CO2(g)+
O2(g)=2CO2(g)+![]() H2O(g)+
H2O(g)+![]() N2(g) ΔH=-1872.6 kJ·mol-1
N2(g) ΔH=-1872.6 kJ·mol-1
(1)写出CH3OH(g)与NH3(g)转化为CH3NHCH3(g)和H2O(g)的热化学方程式是____________。
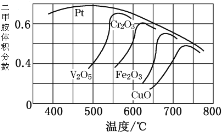
(2)不同的催化剂对二甲胺合成催化效率不同(如图所示),则最合适的催化剂及温度是_____________
(3)一定条件下,原料气中n(CH3OH)/n(NH3)比值和温度对NH3平衡转化率影响的实验数据如图:
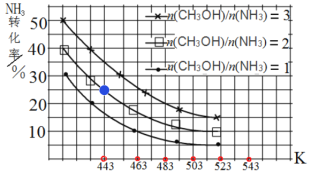
①温度为443 K时,在1 L反应容器中投入4 mol NH3和8 mol CH3OH进行反应,试计算达到平衡时CH3NHCH3(g)浓度为_________molL-1,该温度下化学平衡常数为_____________
②结合图中数据,归纳 NH3平衡转化率受外界条件影响的变化规律:a:_______b:________
(4)二甲胺水溶液类似于氨水,呈碱性;则二甲胺在水中的电离方程式为__________
(5)常温下,将二甲胺和盐酸等体积混合,两种溶液的物质的量浓度和混合溶液的pH如表所示:
实验编号 | 二甲胺浓度(mol.L-1) | 盐酸浓度(mol.L-1) | 混合后溶液的PH |
甲 | 0.1 | 0.1 | a |
乙 | 0.15 | 0.1 | 8 |
丙 | 0.2 | 0.1 | 10 |
①实验甲中,a______(填“大于”、“小于”或“等于”)7
②实验丙混合后的溶液中离子浓度大小关系为______________
查看答案和解析>>
科目: 来源: 题型:
【题目】如图中的A、B、C、D、E、F、G均为有机物。
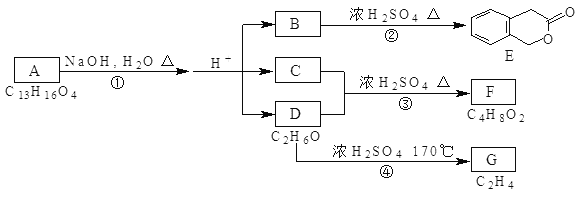
据上图回答问题:
(1)D的名称为:___;
(2)A的结构简式是___;
(3)反应③的化学方程式是:___;
(4)符合下列3个条件的B的同分异构体的数目有___个;
I、含有二取代苯环结构 II、与B有相同官能团 III、不与FeCl3溶液发生显色反应。写出其中属于邻二取代苯环结构的任意一个同分异构体的结构简式___;
(5)B不仅可以生成E,还可以在一定条件下形成高分子化合物,写出B形成高分子化合物的化学方程式:___。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,烧杯内盛有浓硝酸,在烧杯内放入用导线连接的铁、铅两个电极,已知原电池停止工作时,Fe、Pb均有剩余。下列说法正确的是( )
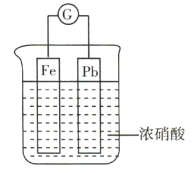
A.Fe比Pb活泼,故Fe始终作负极
B.Fe在浓硝酸中钝化,故始终不溶解
C.原电池停止工作时,溶液中有![]()
D.利用浓硝酸作电解质溶液不符合“绿色化学”的思想
查看答案和解析>>
科目: 来源: 题型:
【题目】1 L某混合溶液中,溶质X、Y浓度都为0.1mol·L—1,向混合溶液中滴加0.1 mol·L—1某溶液Z,所得沉淀的物质的量如图所示,则X、Y、Z分别是 ( )
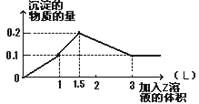
A.偏铝酸钠、氢氧化钡、硫酸
B.氯化铝、氯化镁、氢氧化钠
C.氯化铝、氯化铁、氢氧化钠
D.偏铝酸钠、氯化钡、硫酸
查看答案和解析>>
科目: 来源: 题型:
【题目】取等物质的量浓度的NaOH溶液两份A和B,每份10 mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1 mol/L的盐酸,标准状况下产生的CO2的体积与所加盐酸体积之间的关系如下图所示,试回答下列问题:
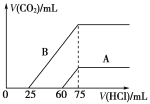
(1)原NaOH溶液的物质的量浓度为____________mol/L。
(2)曲线A表明,原NaOH溶液中通入CO2后,所得溶液中的溶质成分是____________,其物质的量之比为__________。
(3)曲线B表明,所得溶液加盐酸后产生CO2气体体积(标况)的最大值为 mL。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是某课外活动小组设计的用化学电源使LED灯发光的装置。下列说法不正确的是( )

A.装置中存在“化学能→电能→光能”的转化
B.锌片上发生的电极反应为![]()
C.如果将稀硫酸换成柠檬汁,则导线中不会有电子流动
D.如果将锌片换成铁片,则电路中的电流方向不变
查看答案和解析>>
科目: 来源: 题型:
【题目】25 ℃时,分别向20.00 mL 0.100 0 mol·L-1的氨水、醋酸铵溶液中滴加0.100 0 mol·L-1的盐酸,溶液pH与加入盐酸体积的变化关系如图所示。下列说法错误的是( )
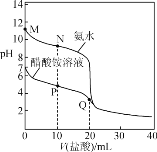
A.氨水的电离平衡常数的数量级约是10-5
B.N点:c(NH4+)>c(Cl-)>c(NH3·H2O)>c(OH-)
C.P点:c(NH4+)<2c(CH3COO-)+c(NH3·H2O)
D.Q点:2c(Cl-)=c(CH3COOH)+c(NH4+)
查看答案和解析>>
科目: 来源: 题型:
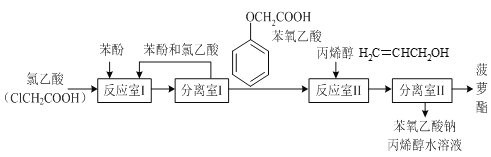
【题目】实验室模拟工业生产食品香精菠萝酯(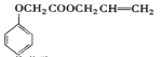 )的简易流程如下:
)的简易流程如下:
有关物质的熔、沸点如表:
苯酚 | 氯乙酸 | 苯氧乙酸 | |
熔点/℃ | 43 | 62 | 99 |
沸点/℃ | 181.9 | 189 | 285 |
试回答下列问题:
(1)反应室I中反应的最佳温度是104℃,为较好地控制温度在102℃~106℃之间,加热时可选用___(选填字母)。
A.火炉直接加热 B.水浴加热 C.油浴加热
(2)分离室I采取的操作名称是___。
(3)反应室I中发生反应的化学方程式是___。
(4)分离室II的操作为:①用NaHCO3溶液洗涤后分液;②有机层用水洗涤后分液;洗涤时不能用NaOH溶液代替NaHCO3溶液,其原因是___(用化学方程式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com