
科目: 来源: 题型:
【题目】下列实验操作能达到目的的是( )

A.用灼烧的方法鉴别棉麻与真丝
B.加入浓溴水除去苯中溶解的杂质苯酚
C.用图甲装置制取并收集乙酸乙酯
D.用图乙装置验证溴乙烷与NaOH醇溶液共热产生了乙烯
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A. 按系统命名法,化合物![]() 的名称为2-2-二甲基己烷
的名称为2-2-二甲基己烷
B. 等质量的聚乙烯、甲烷、乙炔分别充分燃烧,所耗氧气的量依次减少
C. 用酒精消毒,其原理是酒精使细菌中的蛋白质变性而失去生理活性
D. 蔗糖、麦芽糖和乳糖的分子式都为C12H22O11,均能发生银镜反应
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)____S+____NaOH![]() 2Na2S+____Na2SO3+____H2O
2Na2S+____Na2SO3+____H2O
(2)____Cl2+____Ca(OH)2![]() ____CaCl2+____Ca(ClO)2+____H2O
____CaCl2+____Ca(ClO)2+____H2O
(3)____P4+____KOH+____H2O=____K3PO4+____PH3↑
查看答案和解析>>
科目: 来源: 题型:
【题目】为建设美丽浙江,浙江省政府开展“五水共治”。
(1)城市饮用水处理时可用二氧化氯(ClO2)替代传统的净水剂Cl2。工业上可用Cl2氧化NaClO2溶液制取ClO2。写出该反应的离子方程式,并标出电子转移的方向和数目:_______________。
(2)某地污水中的有机污染物主要成分是三氯乙烯 (C2HCl3),向此污水中加入KMnO4(高锰酸钾的还原产物为MnO2)溶液可将其中的三氯乙烯除去,氧化产物只有CO2,写出该反应的化学方程式_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。
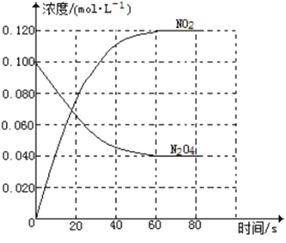
回答下列问题:
(1)反应的△H______0(填“大于”“小于”);100℃时,体系中各物质浓度随时间变化如上图所示。在0~60s时段,反应速率v(N2O4)为___________molL-1s-1反应的平衡常数K1为___________。
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020 molL-1s-1的平均速率降低,经10s又达到平衡。
①T_______100℃(填“大于”“小于”),判断理由是_____。
②列式计算温度T是反应的平衡常数K2___________
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向___________(填“正反应”或“逆反应”)方向移动,判断理由是___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是![]()
A.淀粉水解液酸化后加入碘水就能判断淀粉是否水解完全
B.植物秸秆、牛油彻底水解的产物均为纯净物
C.鸡蛋清中加入饱和碳酸钠溶液,生成的沉淀加水不再溶解
D.葡萄糖与果糖、淀粉与纤维素均互为同分异构体
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)KClO3可用于实验室制O2,若不加催化剂,400 ℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1∶1。写出该反应的化学方程式: ____________________。
(2)在某强酸性混合稀土溶液中加入H2O2,调节pH≈3,Ce3+通过下列反应形成Ce(OH)4沉淀得以分离。完成反应的离子方程式:______________________
![]() Ce3++
Ce3++![]() H2O2+
H2O2+![]() H2O===
H2O===![]() Ce(OH)4↓+
Ce(OH)4↓+![]() ________
________
(3)As可以与NaClO的水溶液反应,生成其最高价含氧酸(H3AsO4),写出该反应的化学方程式 : _____。
查看答案和解析>>
科目: 来源: 题型:
【题目】淀粉通过如图所示转化可以得到多种有机物:
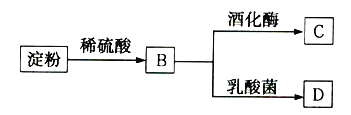
(1)检验淀粉是否完全水解,可以选用的试剂是__________(填序号)。
a.石蕊试液 b.淀粉碘化钾溶液 c.碘水
(2)B是一种单糖,则B的名称是____________________。
(3)B转化为C的化学方程式是______________________________。
(4)一分子B可在乳酸菌作用下分解生成两分子D,D与乙酸、乙醇均能发生酯化反应,且D的结构中含有甲基,则D的结构简式是______________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于SiO2晶体说法正确的是( )
A.SiO2是由极性键构成的非极性分子
B.若NA表示阿伏加德罗常数,常温常压下60g SiO2中含有的共价键数目为2NA
C.碳和硅同主族,因此CO2和SiO2化学性质相似,物理性质也相似
D.SiO2晶体结构中的最小环为6个Si和6个O组成的12元环
查看答案和解析>>
科目: 来源: 题型:
【题目】氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO3-+4H++3e-=NO↑+2H2O;已知KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该反应的离子方程式;用“单线桥法”标出电子转移的方向和数目: _______________。
(2)反应中硝酸体现了_________、_________性质。
(3)反应中若转移3mol电子,则在标况下产生的气体体积是________L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com