
科目: 来源: 题型:
【题目】MnCO3是信息产业和机电工业的重要基础功能材料,某地有含锰矿石(主要成分是MnO2还含CaO、Al2O3、FeS等杂质),由此矿石生产MnCO3的工艺流程如下:
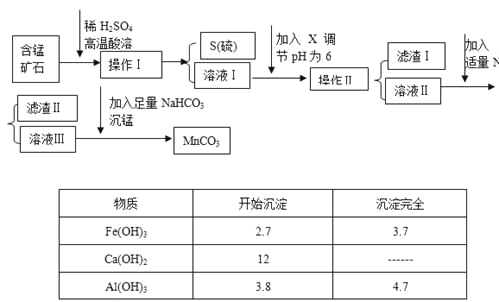
回答下列问题:
(1)操作Ⅰ为:___________。
(2)取溶液Ⅰ加入KSCN溶液,溶液呈血红色,试写出酸溶过程中FeS发生反应的离子方程式:
(3)调节溶液pH所用物质X最好为(_______)
A.NaOH溶液 | B.氨水 | C.MnCO3固体 | D.盐酸 |
(4)滤渣Ⅰ为___________,滤渣Ⅱ为___________。
(5)沉锰的化学方程式为:______________________。
(6)MnCO3也是制造锂离子电池的重要原料,在此电池的正极,充放电过程中发生LiMn2O4与Li1-xMn2O4之间的转化,写出该电池充电时正极发生的反应式:________。
查看答案和解析>>
科目: 来源: 题型:
【题目】
教材插图具有简洁而又内涵丰富的特点。请回答以下问题:
(1)第三周期的某主族元素,其第一至第五电离能数据如图1所示,则该元素对应的原子有_____种不同运动状态的电子。
(2)如图2所示,每条折线表示周期表ⅣA ~ⅦA 中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是___________。判断依据是____________。
(3)CO2在高温高压下所形成的晶体其晶胞如图3所示。则该晶体的类型属于_____________晶体。
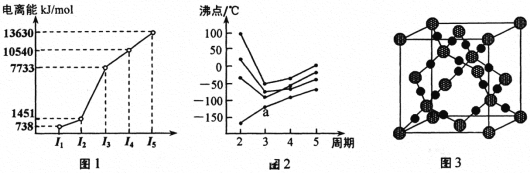
(4)第一电离能介于Al、P之间的第三周期元素有____种。 GaCl3中中心原子的杂化方式为_________,写出与GaCl3结构相同的一种等电子体(写离子)______________。
(5)冰、干冰、碘都是分子晶体,冰的结构具有特殊性,而干冰、碘的晶体具有相似的结构特征,干冰分子中一个分子周围有__________个紧邻分子。 D的醋酸盐晶体局部结构如图,该晶体中含有的化学键是_____________(填字母标号)。
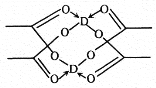
a.极性键 b.非极性键 c.配位键 d.金属键
(6)Fe的一种晶体如甲、乙所示,若按甲虚线方向切乙得到的A~D图中正确的是_____(填字母标号)。

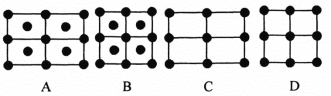
铁原子的配位数是____________,假设铁原子的半径是r cm,该晶体的密度是ρg/cm3 ,则铁的相对原子质量为________________(设阿伏加德罗常数的值为NA)。
查看答案和解析>>
科目: 来源: 题型:
【题目】将等量的N2和H2的混合气体分别充入甲、乙、丙三个容器中,进行反应![]() ,经过相同的时间后,测得反应速率分别为甲:v(H2)=1 mol·L-1·min-1,乙:v(N2)=2 mol·L-1·min-1,丙:v(NH3)=3 mol·L-1·min-1。则三个容器中合成氨的反应速率大小关系为( )
,经过相同的时间后,测得反应速率分别为甲:v(H2)=1 mol·L-1·min-1,乙:v(N2)=2 mol·L-1·min-1,丙:v(NH3)=3 mol·L-1·min-1。则三个容器中合成氨的反应速率大小关系为( )
A.v(甲)>v(乙)>v(丙)B.v(乙)>v(丙)>v(甲)
C.v(丙)>v(甲)>v(乙)D.v(乙)>v(甲)>v(丙)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式中书写正确的有几项![]()
![]() 固体与稀硝酸混合:
固体与稀硝酸混合:![]()
![]() 用过量氨水吸收烟道气中的
用过量氨水吸收烟道气中的![]() :
:![]()
![]() 将少量
将少量![]() 气体通入NaClO溶液中:
气体通入NaClO溶液中:![]()
![]() 已知
已知![]() ,向NaClO溶液中通入少量
,向NaClO溶液中通入少量![]() :
:![]()
![]() 铁屑溶于足量稀硝酸:
铁屑溶于足量稀硝酸:![]()
![]() 氯气溶于水:
氯气溶于水:![]()
![]() 实验室用
实验室用![]() 和
和![]() 制氨气:
制氨气:![]()
![]()
![]()
![]() 向
向![]() 溶液中逐滴加入
溶液中逐滴加入![]() 溶液至
溶液至![]() 恰好沉淀完全:
恰好沉淀完全:![]()
![]() 实验室制
实验室制![]() :
:![]() 浓
浓![]() 十
十![]()
![]()
![]()
![]() 溶液刻蚀铜制电路板:
溶液刻蚀铜制电路板:![]()
A.1项B.2项C.3项D.4项
查看答案和解析>>
科目: 来源: 题型:
【题目】催化还原CO2是解决温室效应及能源问题的重要手段之一,研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO,反应的热化学方程式如下:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-53.7kJmol-1 I
CH3OH(g)+H2O(g) △H1=-53.7kJmol-1 I
CO2(g)+H2(g)![]() CO(g)+H2O(g) △H2 II
CO(g)+H2O(g) △H2 II
某实验室控制CO2和H2初始投料比为1︰2.2,在相同压强下,经过相同反应时间测得如下实验数据:
T(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
543 | Cat.1 | 12.3 | 42.3 |
543 | Cat.2 | 10.9 | 72.7 |
553 | Cat.1 | 15.3 | 39.1 |
553 | Cat.2 | 12.0 | 71.6 |
[备注]Cat.1:Cu/ZnO纳米棒;Cat.2:Cu/ZnO纳米片;甲醇选择性:转化的CO2中生成甲醇的百分比
(1)表中实验数据表明,在相同温度下不同的催化剂对CO2转化成CH3OH的选择性有显著的影响,其原因是___。
(2)在如图中分别画出反应I在无催化剂、有Cat.1和有Cat.2三种情况下“反应过程-能量”示意图___。

查看答案和解析>>
科目: 来源: 题型:
【题目】①已知白磷和氯酸溶液可发生如下反应,将该反应进行配平:
______P4+_______HClO3+_______ ______=______HCl+____H3PO4
②白磷有毒,有实验室可采用CuSO4溶液进行处理,其反应为:11P4+60CuSO4+96H2O=20Cu3P+24H3PO4+60H2SO4
在该反应中30 mol CuSO4可氧化P4的物质的量是______mol.
查看答案和解析>>
科目: 来源: 题型:
【题目】三氯氢硅(SiHCl3)是制备硅烷、多晶硅的重要原料。回答下列问题:
对于反应2SiHCl3(g)=SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323K和343K时SiHCl3的转化率随时间变化的结果如图所示。
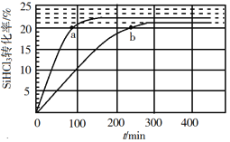
在343K下:要提高SiHCl3转化率,可采取的措施是___;要缩短反应达到平衡的时间,可采取的措施有___、___。
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.尿素[CO(NH2)2]是人工合成的第一种有机物。
(1)尿素中所含元素的电负性最大的是______,尿素分子间的氢键可表示为______。
(1)尿素可用于制有机铁肥,主要代表有[Fe(H2NCONH2)6](NO3)3。
①与铁同周期且未成对电子数与Fe3+相同的元素是______。
②[Fe(H2NCONH2)6](NO3)3中存在的化学键______![]() 填序号
填序号![]() 。
。
A.离子键B.金属键C.配位键D.σ键E.π键
③![]() 中N原子杂化后的价电子排布图为______,
中N原子杂化后的价电子排布图为______,![]() 的空间构型为______。
的空间构型为______。
Ⅱ.Mg2NiH4是一种贮氢的金属氢化物
(3) Mg2NiH4可通过氢化镁和镍单质球磨制成。在Mg2NiH4晶胞中,Ni原子占据如图的顶点和面心, Mg2+处于如图八个小立方体的体心。
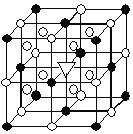
①Mg2NiH4中H的化合价为______。
②Mg2+位于Ni原子形成的______ (填“八面体空隙”或“四面体空隙”)。
③若晶体的密度为d g·cm-3,Mg2NiH4的摩尔质量为M g·mol-1,则Mg2+和Ni原子的最短距离为______nm(用含d、M的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】氮氧化物、二氧化硫是造成大气污染的主要物质,某科研小组进行如下研究。
(1)已知:
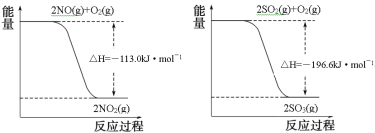
写出SO2(g)与NO2(g)反应生成SO3(g)和NO(g)的热化学方程式___。
(2)向容积为1L密闭容器中分别充入0.10molNO2和0.15molSO2,在不同温度下测定同一时刻NO2的转化率,结果如图所示。
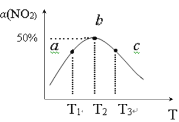
①a、c两点反应速率大小关系:υ(a)___υ(c)。(填“>”、“<”或“=”)
②温度为T2时从反应开始经过2min达到b点,用SO3表示这段时间的反应速率为___,此温度下该反应的平衡常数为___,若在此温度下,保持容器的容积不变,再向容器中充入0.20molNO2和0.30molSO2,NO2的转化率___。(填“增大”、“减小”或“不变”)
③NO2的转化率随温度升高先增大后减小的原因是:___。
(3)常温下用NaOH溶液吸收SO2,在吸收过程中,溶液pH随n(SO32-)∶n(HSO3-)变化关系如下表:
n(SO32-)∶n(HSO3-) | 91∶9 | 1∶1 | 9∶91 |
pH | 8.2 | 7.2 | 6.2 |
当吸收液呈中性时,溶液中离子浓度由大到小排列顺序为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】由Cu、N、B等元素组成的新型材料有着广泛用途。
(1)基态 Cu+ 的核外电子排布式为____________。在高温下CuO 能分解生成Cu2O,试从原子结构角度解释其原因:_______________________________。
(2)立方氮化硼是一种新型的超硬、耐磨、耐高温的结构材料,它属于____晶体。
(3)化合物A (H3BNH3) 是一种潜在的储氢材料,它可由六元环状化合物 (HB=NH)3通过3CH4+ 2 (HB=NH)3+ 6H2O →3CO2 + 6H3BNH3 制得。
①与上述化学方程式有关的叙述不正确的是_________。(填标号)
A.反应前后碳原子的轨道杂化类型不变 |
B.CH4、H2O、CO2分子空间构型分别是:正四面体形、V形、直线形 |
C.第一电离能:N>O>C>B |
D.化合物A中存在配位键 |
②1个 (HB=NH)3分子中有__个σ键。
(4)在硼酸盐中,阴离子有链状、环状等多种结构形式。图(a)是一种链状结构的多硼酸根,则多硼酸根离子符号为________。图(b)是硼砂晶体中阴离子的环状结构,其中硼原子采取的杂化类型为_________。


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com