
科目: 来源: 题型:
【题目】Ⅰ.氮的固定是几百年来科学家一直研究的课题。
(1)下表列举了不同温度下大气固氮和工业固氮的部分K值。
反应 | 大气固氮 N2(g)+O2(g) | 工业固氮 N2(g)+3H2(g) | |||
温度/℃ | 27 | 2000 | 25 | 400 | 450 |
K | 3.8×10﹣31 | 0.1 | 5×108 | 0.507 | 0.152 |
①分析数据可知:大气固氮反应属于_____(填“吸热”或“放热”)反应。
②分析数据可知;人类不适合大规模模拟大气固氮的原因__________________________。
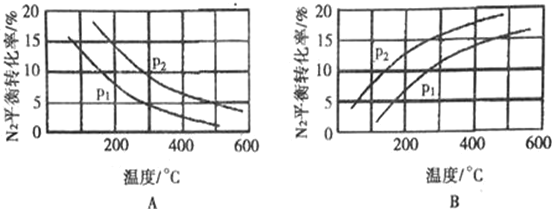
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(P1、P2)下随温度变化的曲线,如图所示的图示中,正确的是___(填“A”或“B”);比较P1、P2的大小关系:P1______P2(填“>”、“=” 或“<”)。
Ⅱ. 目前工业合成氨的原理是:N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
(3)在一定温度下,将1mol N2和3mol H2混合置于体积不变的密闭容器中发生反应,达到平衡状态时,测得气体总物质的量为2.8mol。达平衡时,H2的转化率α1=____。
查看答案和解析>>
科目: 来源: 题型:
【题目】以SO2为原料,通过下列工艺可制备化工原料H2SO4和清洁能源H2。下列说法中不正确的是

A. 该生产工艺中Br2被循环利用
B. 在电解过程中,电解槽阴极附近溶液的pH变大
C. 原电池中负极发生的反应为SO2+2H2O-2e-=SO42-+4H+
D. 该工艺总反应的化学方程式表示为SO2+Br2+2H20=2HBr+H2SO4
查看答案和解析>>
科目: 来源: 题型:
【题目】Pd/A12O3催化H2还原CO2的机理示意如图。下列说法不正确的是
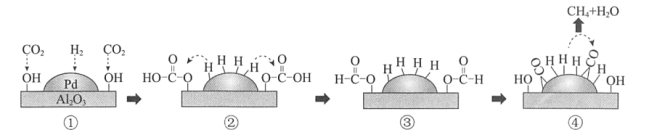
A.H-H的断裂需要吸收能量
B.①-②,CO2发生加成反应
C.④中,CO被氧化为CH4
D.生成CH4的总反应方程式是CO2+4H2![]() CH4+2H2O
CH4+2H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】把1mol X气体和0.5mol Y气体混合于2L的密闭容器中,发生如下反应:
![]() ,2min末生成0.2mol W,若测得以Z的物质的量浓度变化表示的平均反应速率为0.1mol·L-1·min-1,试计算
,2min末生成0.2mol W,若测得以Z的物质的量浓度变化表示的平均反应速率为0.1mol·L-1·min-1,试计算
(1)前2min内,用X表示的平均反应速率____________。
(2)前2min内Y的转化率____________。
(3)化学方程式中Z的化学计量数n____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】深埋在潮湿土壤中的铁管道,在硫酸盐还原菌作用下,能被硫酸根腐蚀,其电化学腐蚀原理如图示,下列与此原理有关说法错误的是
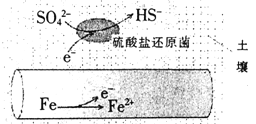
A. 正极反应为:SO42-+5H2O+8e-=HS-+9OH-
B. 输送暖气的管道不易发生此类腐蚀
C. 这种情况下,Fe腐蚀的最终产物为Fe2O3·xH2O
D. 管道上刷富锌油漆可以延缓管道的腐蚀
查看答案和解析>>
科目: 来源: 题型:
【题目】已知醋酸和盐酸是日常生活中极为常见的酸,在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH![]() CH3COO+H+ ΔH>0。
CH3COO+H+ ΔH>0。
(1)常温常压下,在pH=5的稀醋酸溶液中,c(CH3COO)=__;(精确值)下列方法中,可以使0.10mol·L-1CH3COOH的电离程度增大的是___。
a.加入少量0.10mol·L1的稀盐酸 b.加热CH3COOH溶液 c.加入少量冰醋酸 d.加水稀释至0.010mol·L-1 e.加入少量氯化钠固体 f.加入少量0.10mol·L-1的NaOH溶液
(2)已知:90℃时,水的离子积常数为Kw=38×10-14,在此温度下,将pH=3的盐酸和pH=11的氢氧化钠溶液等体积混合,则混合溶液中的c(H+)=___(保留三位有效数字)。
(3)现有浓度均为0.1mol/L的下列溶液:①硫酸 ②醋酸 ③氢氧化钠 ④氯化铵 ⑤醋酸铵 ⑥硫酸铵 ⑦硫酸氢铵 ⑧氨水,请回答下列问题:
ⅰ.①、②、③、④四种溶液中由水电离出的H+的浓度由大到小的顺序是(填序号)__。
ⅱ.④、⑤、⑥、⑦、⑧五种溶液中NH4+浓度由大到小的顺序是(填序号)___。
(4)一定条件下甲醇与一氧化碳反应可以合成乙酸。常温条件下,将a mol/L的CH3COOH与b mol/LBa(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)=c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物A由三种元素组成,某兴趣小组进行了如下实验:

已知:气体甲为纯净物且只含两种元素,在标况下体积为672 mL;溶液乙为建筑行业中常用的粘合剂。
请回答下列问题:
(1)A的组成元素为________(用元素符号表示);
(2)写出气体甲与NaOH(aq)反应的离子方程式________;
(3)高温下,A与足量氯气能发生剧烈爆炸,生成三种常见化合物试写出相应的化学方程式________。
查看答案和解析>>
科目: 来源: 题型:
【题目】连二亚硫酸钠(Na2S2O4)是印染工业的一种常用原料,连二亚硫酸钠又称保险粉,可溶于水,但不溶于甲醇,其固体受热、遇水都会发生反应放出大量的热,甚至引起燃烧,工业制备流程如图:
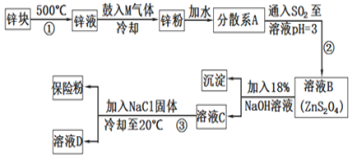
请回答下列问题:
(1)保存连二亚硫酸钠的注意事项___(任写一项)。
(2)鼓入的气体M为空气的一种主要成分,则M的电子式为___;
(3)流程②的化学方程式为__。
(4)流程③的分离方法步骤为过滤、洗涤、干燥。其中洗涤所用试剂是___;实验时加入NaCl固体的作用是__。
(5)连二亚硫酸钠可以用于除去废水中的重铬酸根离子(Cr2O72-被转化为Cr3+,S2O42-被转化为SO42-),写出该反应的离子方程式___。
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、X均为中学化学常见的物质。它们之间存在如下图所示转化关系(图中反应条件略去)填写下列空白:
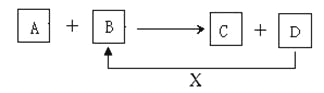
(1)若A为金属铝,B为氧化铁,写出反应A+B→C+D的一种用途______
(2)若A为两性氢氧化物, B为NaOH溶液,写出反应A+B→C+D的离子方程式________________。
(3)若A为金属单质,B、C、D都是化合物,A与B发生的反应常用于刻制印刷电路板,该反应的离子方程式________________________________________。
(4)若A、B、C为化合物,D、X为单质,A、B、C中肯定含有X元素的是________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com