
科目: 来源: 题型:
【题目】如图①Ⅰ、Ⅱ、Ⅲ是常见的气体发生装置,Ⅳ、Ⅴ、Ⅵ是气体收集装置。根据要求回答下列问题: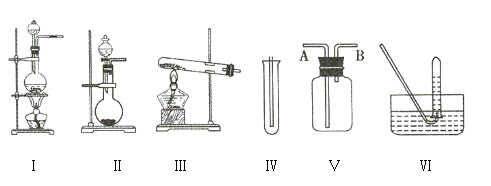
(1)若用![]() 与浓盐酸反应制取氯气,应选用装置 ___________________ 。
与浓盐酸反应制取氯气,应选用装置 ___________________ 。
(2)若用![]() 与浓盐酸反应制取氯气,应选用装置 ___________________ ,试完成并配平下列离子方程式:
与浓盐酸反应制取氯气,应选用装置 ___________________ ,试完成并配平下列离子方程式:
___________________ ![]() + ___________________
+ ___________________ ![]() + ___________________
+ ___________________ ![]() ___________________
___________________ ![]() + ___________________
+ ___________________ ![]() + ___________________ 。
+ ___________________ 。
(3)若选用装置Ⅳ为氯气的收集装置,则应该在试管口中放置一团棉花,该棉花团需用 ___________________ 溶液浸润,其作用是 ___________________ 。
(4)若选用装置Ⅴ为氯气的收集装置,则氯气应从 ___________________ (填“A”或“B”)口通入,利用化学原理检验氯气已收集满的方法是 ___________________ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,A、B、C是实验室常用的三种气体发生装置,现有药品:大理石、浓盐酸、稀盐酸、锌粒、二氧化锰、氯化铵、熟石灰。欲利用这些药品制取NH3、Cl2、H2、CO2四种气体,试回答下列问题。
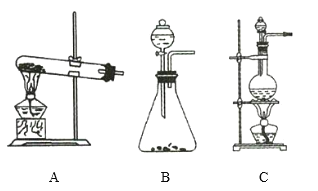
(1)①写出制取氨气的化学方程式: _____________________ ,氨气可用 _____________________ 进行干燥。
②制取![]() 的化学方程式为 _____________________ ,制取
的化学方程式为 _____________________ ,制取![]() 应选用装置 _____________________ (填序号)。
应选用装置 _____________________ (填序号)。
(2)①制取![]() 应选用装置 _____________________ (填序号)。
应选用装置 _____________________ (填序号)。
②生成的氯气先通过盛有 _____________________ 的洗气瓶,除去 _____________________ 气体。
查看答案和解析>>
科目: 来源: 题型:
【题目】100℃时,将0.1molN2O4置于1L密闭的烧瓶中,然后将烧瓶放入100℃的恒温槽中,烧瓶内的气体逐渐变为红棕色:N2O4(g)![]() 2NO2(g)。下列结论不能说明上述反应在该条件下已经达到平衡状态的是)
2NO2(g)。下列结论不能说明上述反应在该条件下已经达到平衡状态的是)
①N2O4的消耗速率与NO2的生成速率之比为1:2
②NO2生成速率与NO2消耗速率相等
③烧瓶内气体的压强不再变化
④烧瓶内气体的质量不再变化
⑤NO2的物质的量浓度不再改变
⑥烧瓶内气体的颜色不再加深
⑦烧瓶内气体的平均相对分子质量不再变化
⑧烧瓶内气体的密度不再变化
A.①④⑧B.②③⑤⑥⑦C.只有①④D.只有⑦⑧
查看答案和解析>>
科目: 来源: 题型:
【题目】氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)2·6H2O的流程如下:

已知:①卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。
②四种化合物的溶解度(S)随温度(T)变化曲线如图所示。

(1)过滤所需要的主要玻璃仪器有___,加MgO后过滤所得滤渣的主要成分为___。
(2)加入BaCl2的目的是除去SO42-,如何检验SO42-已沉淀完全?答:___。
(3)加入NaClO3饱和溶液发生反应为:MgCl2+2NaClO3=Mg(ClO3)2+2NaCl↓,再进一步制取Mg(ClO3)2·6H2O的实验步骤依次为:①___;②___;③___;④过滤、洗涤。
(4)产品中Mg(ClO3)2·6H2O含量的测定:
步骤1:准确称量3.50 g产品配成100 mL溶液。
步骤2:取10 mL于锥形瓶中,加入10 mL稀硫酸和20 mL 1.000 mol·L-1的FeSO4溶液,微热。
步骤3:冷却至室温,用0.100 mol·L-1K2Cr2O7溶液滴定至终点,此过程中反应的离子方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。
步骤4:将步骤2、3重复两次,平均消耗K2Cr2O7溶液15.00 mL。
①写出步骤2中发生反应的离子方程式:___
②产品中Mg(ClO3)2·6H2O的质量分数为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】由两种元素组成的化合物X,是现代工业的重要原料。为探究X的组成,设计并进行如下实验:
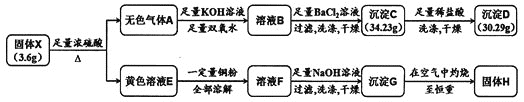
(1)将黄色溶液E稀释后通入无色气体A,发生反应的离子方程式为______________。
(2)除![]() 外,溶液F中一定含有的金属阳离子为________,其检验方法为______________。
外,溶液F中一定含有的金属阳离子为________,其检验方法为______________。
(3)固体X与浓硫酸反应的化学方程式是_________________。
(4)若测得固体H的质量为![]() ,则溶液E溶解的铜粉质量为________。
,则溶液E溶解的铜粉质量为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氢化铝钠![]() 是有机合成中的重要还原剂,其合成路线如图所示。
是有机合成中的重要还原剂,其合成路线如图所示。
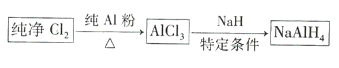
某实验小组利用如图所示的装置制备无水![]() 。
。
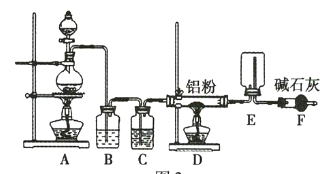
(1)装置F的作用是 _____________________________ 。
(2)![]() 与NaH反应时,需将
与NaH反应时,需将![]() 溶于有机溶剂,再将得到的溶液滴加到NaH粉末上,此反应中NaH的转化率较低的原因可能是 _____________________________
溶于有机溶剂,再将得到的溶液滴加到NaH粉末上,此反应中NaH的转化率较低的原因可能是 _____________________________
(3)利用氢化铝钠遇水反应生成的氢气的体积测定氢化铝钠样品的纯度。
①其反应的化学方程式为 _____________________________
②设计如图四种装置测定氢化铝钠样品的纯度(假设杂质不参与反应)。
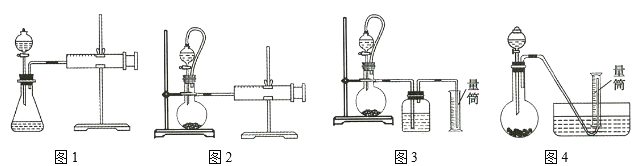
从简约性、准确性角度考虑,最适宜的装置是___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】镁及其化合物有广泛用途。工业上以菱镁矿(主要成分为MgCO3,含SiO2以及少量FeCO3等杂质)为原料制备纳米氧化镁的实验流程如下:
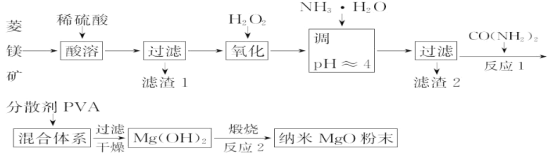
(1)加入H2O2氧化时,发生反应的离子方程式为___。
(2)在实验室煅烧滤渣2制得的金属氧化物为___(填化学式),需要的仪器除酒精灯、三脚架以外,还需要___(填序号)。
①蒸发皿 ②坩埚 ③泥三角 ④石棉网
(3)在一定条件下CO(NH2)2可与H2O反应生成CO2和一种弱碱,反应的化学方程式为___。
(4)25℃时,加入CO(NH2)2至开始产生沉淀,溶液的pH=10时,c(Mg2+)=___molL-1(已知25℃,Ksp[Mg(OH)2]=1.8×10-11)。
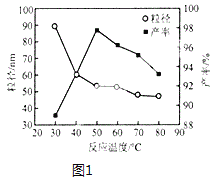
(5)工业上还可用氯化镁和碳酸铵为原料,采用直接沉淀法制备纳米MgO。如图1为反应温度对纳米MgO产率和粒径的影响,据图分析反应的最佳温度为___。
(6)Mg-H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图2如。该电池工作时,石墨电极发生的电极反应为___。
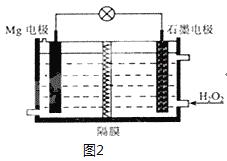
查看答案和解析>>
科目: 来源: 题型:
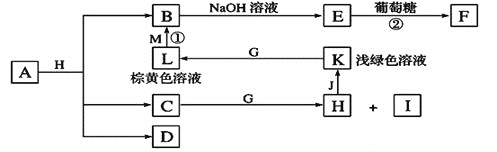
【题目】各物质之间的转化关系如下图,部分生成物省略。C、D是由X、Y、Z中两种元素组成的化合物,X、Y、Z的原子序数依次增大,在周期表中X的原子半径最小,Y、Z原子最外层电子数之和为10。D为无色非可燃性气体,G为黄绿色单质气体,J、M为金属,I有漂白作用,反应![]() 常用于制作印刷线路板。
常用于制作印刷线路板。
请回答下列问题:
(1)![]() 元素在周期表中的位置______________________,C的电子式______________。
元素在周期表中的位置______________________,C的电子式______________。
(2)比较Y与Z的原子半径大小:___________________![]() 填写元素符号
填写元素符号![]() 。
。
(3)写出实验室制备G的离子反应方程式:_________________________________。
(4)气体D与NaOH溶液反应可生成两种盐P和Q,在P中Na的质量分数为![]() ,其俗名为____________。
,其俗名为____________。
(5)实验室中检验L溶液中的阳离子常选用__________![]() 填化学式
填化学式![]() 溶液,现象是__________________________________________。
溶液,现象是__________________________________________。
(6)![]() 中包含X、Y、Z元素,A的化学式为_________________________________。
中包含X、Y、Z元素,A的化学式为_________________________________。
(7)研究表明:气体D在一定条件下可被还原为晶莹透明的晶体N,其结构中原子的排列为正四面体,请写出N及其一种同素异形体的名称______________、_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是 ( )
A.氢气的燃烧热为 △H =-285.5 kJ·mol-1,则电解水的热化学方程式为2H2O(1)![]() 2H2(g)+O2(g) △H =+285.5 kJ·mol-1
2H2(g)+O2(g) △H =+285.5 kJ·mol-1
B.密闭容器中,9.6 g硫粉与11.2 g铁粉混合加热生成硫化亚铁17.6 g时,放出19.12 kJ热量,则Fe(s)+S(s) ===FeS(s) △H =-95.6 kJ·mol-l
C.500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2 (g)+3H2 (g) ![]() 2NH3 (g)△H =-38.6 kJ·mol-l
2NH3 (g)△H =-38.6 kJ·mol-l
D.相同条件下,在两个相同的恒容密闭容器中,1 mol N2和3 mol H2反应放出的热量与2 mol NH3分解吸收的热量一定一样多
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,有c(CH3COOH)+c(CH3COO-)=0.1mol·L-1的一组醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH的关系如图所示。下列有关溶液中离子浓度关系的叙述不正确的是( )
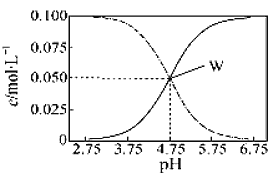
A.pH=5.5的溶液中:c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-)
B.W点所表示的溶液中:c(Na+)+c(H+)=c(CH3COOH)+c(OH-)
C.pH=3.5的溶液中:c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1 mol·L-1
D.向W点所表示的1.0L溶液中通入0.05molHCl气体(忽略溶液体积变化):c(H+)=c(CH3COOH)+c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com