
科目: 来源: 题型:
【题目】如图所示装置,电流表指针发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的( )
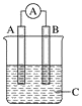
A. A是Zn,B是Cu,C为稀硫酸
B. A是Cu,B是Zn,C为稀硫酸
C. A是Fe,B是Ag,C为稀AgNO3溶液
D. A是Ag,B是Fe,C为稀AgNO3溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】SF6 是一种优良的绝缘气体,分子结构中只有S─F键。已知:1 mol S(s)转化为气态硫原子吸收能量280 kJ,断裂1 mol F─F 、S─F键需吸收的能量分别为160 kJ、330 kJ。则1 mol 固体硫单质参加:S(s)+3F2(g)=SF6(g)反应,完全生成SF6(g)的热效应为( )
A. 吸收430 kJ B. 释放450 kJ
C. 释放1220 kJ D. 释放1780 kJ
查看答案和解析>>
科目: 来源: 题型:
【题目】氯气是一种重要的工业原料,液氯储存区贴有的说明卡如下:
包装 | 钢瓶 |
储运要求 | 远离金属粉末、氨、烃类、醇类物质;设置氯气检测仪 |
泄漏处理 | NaOH、NaHSO3溶液吸收 |
下列解释事实的方程式不正确的是
A. 氯气用于自来水消毒:Cl2 + H2O![]() 2H+ + Cl-+ ClO-
2H+ + Cl-+ ClO-
B. 电解饱和食盐水制取Cl2:2Cl- +2H2O![]() 2OH-+ H2↑+Cl2↑
2OH-+ H2↑+Cl2↑
C. 浓氨水检验泄露的氯气,产生白烟:8NH3 + 3Cl2 === 6 NH4Cl + N2
D. 氯气“泄漏处理”中NaHSO3溶液的作用:HSO3-+ Cl2 + H2O === SO42-+ 3H+ + 2Cl-
查看答案和解析>>
科目: 来源: 题型:
【题目】I.红磷P(s)和Cl2(g)发生反应生成PCl3和PCl5,反应过程和能量关系如图所示(图中的ΔH表示生成1mol产物的数据),根据下图回答下列问题:

(1)PCl5分解生成PCl3和Cl2的热化学方程式____________________;上述分解反应是一个可逆反应,温度T1时,在密闭容器中加入0.8molPCl5,反应达到平衡时还剩余0.6molPCl5,其分解率α1等于________;若反应温度由T1升高到T2,平衡时PCl5的分解率α2,α2________α1(填“大于”、“小于”或“等于”)。
(2)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5。原因是_________________________________________________。
(3)P和Cl2分两步反应生成1molPCl5的ΔH3=____________。
Ⅱ.某学生做浓度对化学反应速率的影响的实验时,将2支试管编号为①②,并按下表中物质的量进行实验,记录的时间数据是:16s、28s。请将2个数据填入下表的适当位置,并写出实验结论。
试管编号 | 加入3%Na2S2O3 | 加H2O | 加稀盐酸(1∶5) | 出现浑浊时间 |
① | 3mL | 3mL | 5滴 | a._____s |
② | 4mL | 2mL | 5滴 | b._____s |
(1)将对应①②的时间分别写出:a.____________,b.____________。
(2)实验结论____________________________________。
(3)写出反应的化学方程式_______________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】有八种物质:①甲烷、②苯、③聚丙烯、④聚异戊二烯、⑤2一丁炔、⑥环己烷 ⑦邻二甲苯⑧裂解气,既能使酸性KMnO4溶液褪色又能与溴水反应使之褪色的是( )
A.③④⑤⑦⑧B.④⑤⑧C.④⑤⑦⑧D.③④⑤⑧
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上回收利用某合金废料(主要含Fe、Cu、Co、Li等,已知Co、Fe都是中等活泼金属)的工艺流程如下:
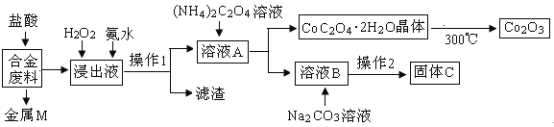
(1)金属M为__________,操作1为___________。
(2)加入H2O2的作用是(用离子方程式表示)________,加入氨水的作用是________。
(3)充分焙烧的化学方程式为____________。
(4)已知Li2CO3微溶于水,其饱和溶液的浓度与温度关系见下表。操作2中,蒸发浓缩后必须趁热过滤,其原因是___________,90℃时Ksp(Li2CO3)的值为___________。
温度/℃ | 10 | 30 | 60 | 90 |
浓度/molL-1 | 0.21 | 0.17 | 0.14 | 0.10 |
(5)用惰性电极电解熔融Li2CO3制取锂,阳极生成两种气体,则阳极的电极反应式为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】钼是一种过渡金属元素,常用作合金及不锈钢的添加剂,这种元素可增强合金的强度、硬度、可焊性及韧性,还可增强其耐高温及耐腐蚀性能。钼酸钠晶体(Na2MoO4·2H2O)常用于制造阻燃剂和无公害型冷水系统的金属抑制剂。下图是利用钼精矿(主要成分是MoS2,含少量PbS等)为原料生产钼酸钠晶体的工艺流程图:
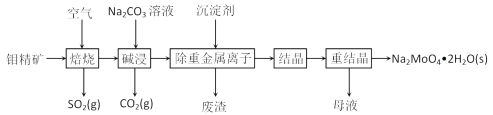
(1)提高焙烧效率的方法有:_____________(写一种)高温下发生焙烧反应的产物为MoO3,请写出该反应的化学方程式 ___________________________________。氧化产物是________________。
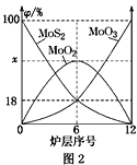
(2)焙烧钼精矿所用的装置是多层焙烧炉,图2为各炉层固体物料的物质的量的百分数(φ)。则x=________。
(3)若在实验室中模拟焙烧操作,需要用到的硅酸盐材料仪器的名称是___________________。
(4)“碱浸”时含钼化合物发生的主要反应的离子方程式为 ______________________。
(5)测得“除重金属离子”中部分离子的浓度:c(MoO42-)=0.20molL1,c(SO42-)=0.01molL1。“结晶”前应先除去SO42-,方法是加入Ba(OH)2固体。假设加入Ba(OH)2固体后溶液体积不变,当BaMoO4开始沉淀时,此时SO42-的浓度_____________。〔已知Ksp(BaSO4)=1×1010,Ksp(BaMoO4)=2.0×108〕
查看答案和解析>>
科目: 来源: 题型:
【题目】K2 FeO4在水中不稳定,发生反应:![]() +l0H2O
+l0H2O![]() 4Fe(OH)3(胶体)+8OH-+3O2,其稳定性与温度(T)和溶液pH的关系分别如下图所示。下列说法不正确的是 ( )
4Fe(OH)3(胶体)+8OH-+3O2,其稳定性与温度(T)和溶液pH的关系分别如下图所示。下列说法不正确的是 ( )
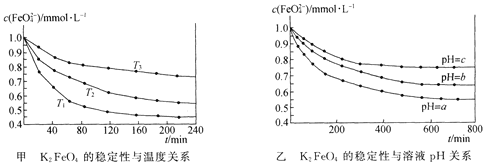
A.由图甲可知上述反应 △H < 0
B.由图甲可知温度:T1 > T2 > T3
C.由图甲可知K2 FeO4的稳定性随温度的升高而减弱
D.由图乙可知图中a < c
查看答案和解析>>
科目: 来源: 题型:
【题目】弱电解质的电离平衡、盐类的水解平衡和难溶物的溶液平衡均属于化学平衡。
(1)已知H2A在水中存在以下平衡:H2A=H++HA-,HA-![]() H++A2-。
H++A2-。
①NaHA溶液的pH_____Na2A溶液的pH(填大于、小于或等于)。
②某温度下,若向0.1mol/L的NaHA溶液中逐滴滴加0.1mol/L的KOH溶液至溶液呈中性。此时该混合溶液中下列关系中,一定正确的是 _____________。
A.c(H+).c(OH-)=1×10-14 B.c(Na+)+c(K+)=c(HA-)+2c(A2-) C.c(Na+)>c(K+) D.c(Na+)+c(K+)=0.05mol/L
(2)常温下,若在0.1mol/L硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)=_________ (Ksp[Cu(OH)2]=2.2×10-20)。
(3)将HI(g)置于密闭容器中,某温度下发生下列变化:2HI(g)![]() H2(g)+I2(g) △H<0
H2(g)+I2(g) △H<0
①该反应平衡常数的表达式为K=____,则H2(g)+I2(g)![]() 2HI(g)平衡常数的表达式为K1=_____(用K表示).
2HI(g)平衡常数的表达式为K1=_____(用K表示).
②当反应达到平衡时c(I2)=0.5mol/L,c(HI)=4mol/L,则c(H2)为_______,HI的分解率为______。
③能判断该反应达到平衡状态的依据是______
A.容器中压强不变 B.混合气体中c(HI)不变 C.c(I2)=c(H2) D.v(I2)正=v(H2)逆
(4)若该反应800℃达到平衡状态,且平衡常数为1.0,某时刻,测得容器内各物质的溶度分别为c(HI)=2mol/L,c(I2)=1mol/L,c(H2)=1mol/L,则该时刻,反应向______(填“正向”或“逆向”,下同)进行,若升高温度,反应向______进行。
查看答案和解析>>
科目: 来源: 题型:
【题目】在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。
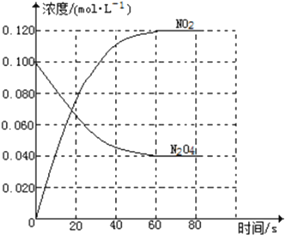
回答下列问题:
(1)反应的△H______0(填“大于”“小于”);100℃时,体系中各物质浓度随时间变化如上图所示。在0~60s时段,反应速率v(N2O4)为___________molL-1s-1反应的平衡常数K1为___________。
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020 molL-1s-1的平均速率降低,经10s又达到平衡。
①T_______100℃(填“大于”“小于”),判断理由是_____。
②列式计算温度T是反应的平衡常数K2___________
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向___________(填“正反应”或“逆反应”)方向移动,判断理由是___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com