
科目: 来源: 题型:
【题目】合金应用广泛,镍铜是重要的合金元素,如镧镍合金、铜镍合金、铝镍合金等。
![]() 基态铜原子的外围电子排布式为______,K和Cu属于同一周期,金属K的熔点比金属Cu______
基态铜原子的外围电子排布式为______,K和Cu属于同一周期,金属K的熔点比金属Cu______![]() 填“高”或“低”
填“高”或“低”![]() ,原因是______。
,原因是______。
![]() 在
在![]() 溶液中滴加稀氨水能形成配位化合物
溶液中滴加稀氨水能形成配位化合物![]() 。
。
![]() 、N、O、Ni的电负性由小到大的顺序为______;
、N、O、Ni的电负性由小到大的顺序为______;
![]() SO42-中S原子的杂化类型是______。
SO42-中S原子的杂化类型是______。
![]() SO42-与互为等电子体的分子的化学式
SO42-与互为等电子体的分子的化学式![]() 写出一种即可
写出一种即可![]() ______;
______;
![]() 工业上,采用反应
工业上,采用反应![]() 提纯粗镍。推测
提纯粗镍。推测![]() 晶体中存在的作用力有______。
晶体中存在的作用力有______。
![]() 非极性键
非极性键![]() 极性键
极性键![]() 范德华力
范德华力![]() 离子键
离子键![]() 配位键
配位键
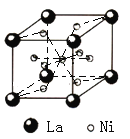
![]() 镧镍合金的晶胞如图1所示,镍原子除了1个在体心外,其余都在面上。该合金中镧原子和镍原子的个数比为______。
镧镍合金的晶胞如图1所示,镍原子除了1个在体心外,其余都在面上。该合金中镧原子和镍原子的个数比为______。
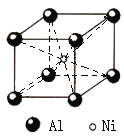
![]() 铝镍合金的晶胞如图所示。已知:铝镍合金的密度为
铝镍合金的晶胞如图所示。已知:铝镍合金的密度为![]() ,
,![]() 代表阿伏加德罗常数的数值,则镍、铝的最短核间距
代表阿伏加德罗常数的数值,则镍、铝的最短核间距![]() 为______。
为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】元素周期表中,除了22种非金属元素外,其余的都是金属,请根据元素周期表回答下列问题:
I.(1)基态氮原子核外共有_______种运动状态不相同的电子,该原子核外电子排布中电子在能量最低的轨道呈_______形,用n表示能层,氟元素所在族的外围电子排布式为______________。
(2)在元素周期表中,某些主族元素与下方的主族元素的性质有些相似,被称为“对角线规则”,如下表:

根据“对角线规则”写出Be(OH)2与NaOH反应的离子方程式______________,硼酸(H3BO3)是一种具有片层结构的白色晶体,层内的H3BO3分子间通过氢键相连(如图)。含1mol H3BO3的晶体中有__________mol氢键,H3BO3中B原子的杂化类型为_____________。

(3)以第二周期为例,除Be、N外,其它元素的第一电离能从左到右逐渐增大的原因是____________________________________________________。
II.近年来铁及其化合物在工农业中有广阔的应用前景。
(4)铁的一种络离子[Fe(CN)6]4-中Fe2+的配位数为6,该络离子中不存在______(填序号)。
A.共价键 B.非极性键 C.配位键 D.δ键 E.π键
(5)AlCl3的熔点比NaCl熔点低的原因是____________________________________。
(6)一种Al-Fe合金的立体晶胞如图所示。若晶体的密度为ρ gcm-3,则此合金中最近的两个Fe原子之间的距离为__________cm(用含ρ的代数式表示)。

查看答案和解析>>
科目: 来源: 题型:
【题目】(1)只用水就能鉴别的一组物质是______
a.苯、乙酸、四氯化碳 b.乙醇、乙醛、乙酸
c.乙醛、乙二醇、硝基苯 d.苯酚、乙醇、甘油
(2)现有化合物:甲: 乙:
乙: 丙:
丙:
①请写出丙中含氧官能团的名称:____。
②请判别上述哪些化合物互为同分异构体:____(填代号)。
(3)A和B两种物质的分子式都是C7H8O芳香族化合物,它们都能跟金属Na反应放出H2;A不溶于NaOH溶液而B能溶于NaOH溶液,B能使FeCl3溶液显紫色,A不能;B苯环上的一溴代物有两种结构。则A和B的名称及结构简式为:A_____,B_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法中,正确的是( )
A.含有羟基的化合物一定属于醇类
B.代表醇类的官能团是与非苯环上的碳相连的羟基
C.酚类和醇类具有相同的官能团,因而具有相同的化学性质
D.分子内有苯环和羟基的化合物一定是酚类
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,在三个容积均为2.0 L的恒容密闭容器中发生反应:2NO(g)+2CO(g) ![]() N2(g)+2CO2(g)。各容器中起始物质的量浓度与反应温度如下表所示:
N2(g)+2CO2(g)。各容器中起始物质的量浓度与反应温度如下表所示:
容器 | 温度/℃ | 起始物质的量浓度/(mol·L-1) | |||
NO(g) | CO(g) | N2 | CO2 | ||
甲 | T1 | 0.10 | 0.10 | 0 | 0 |
乙 | T2 | 0 | 0 | 0.10 | 0.20 |
丙 | T2 | 0.10 | 0.10 | 0 | 0 |
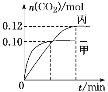
反应过程中甲、丙容器中CO2的物质的量随时间变化关系如图所示。下列说法正确的是
A.该反应的正反应为放热反应,平衡常数K(T1)<K(T2)
B.乙容器中反应达到平衡时,N2的转化率小于40%
C.达到平衡时,乙容器中的压强一定大于甲容器的2倍
D.丙容器中反应达到平衡后,再充入0.10 mol NO和0.10 mol CO2,此时υ(正)<υ(逆)
查看答案和解析>>
科目: 来源: 题型:
【题目】油脂是油与脂肪的总称,它是多种高级脂肪酸的甘油酯。油脂既是重要食物,又是重要的化工原料。油脂的以下用途与其含有的碳碳不饱和键(![]() )有关的是
)有关的是
A. 衣服上的油脂可用汽油洗去
B. 适量摄入油脂,有利于人体吸收多种脂溶性维生素和胡萝卜素
C. 植物油通过氢化可以制造植物奶油(人造奶油)
D. 脂肪是有机体组织里储存能量的重要物质
查看答案和解析>>
科目: 来源: 题型:
【题目】现有A、B、C、D、E五种短周期元素,已知A、B、C、D四种元素的核内质子数之和为56,在元素周期表中的位置如图所示,1 mol E的单质可与足量酸反应,能产生33.6 L H2(在标准状况下);E的阳离子与A的阴离子核外电子层结构相同。
A | ||
B | C | D |
回答下列问题:
(1)写出下列元素名称A__________,B___________,E____________
(2)C的简单离子结构示意图为_____________
(3)B单质在A单质中燃烧,反应现象是__________________________________,生成物的化学式为___________
(4)A与E形成的化合物的化学式为__________,它的性质决定了它在物质的分类中应属于__________________
(5)向D与E形成的化合物的水溶液中滴入烧碱溶液至过量,此过程中观察到的现象是_______________________,写出有关化学反应方程式______________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】![]() 下列物质中,既含有极性共价键,又含有非极性共价键的是______
下列物质中,既含有极性共价键,又含有非极性共价键的是______
A.![]() B.
B.![]() C.
C.![]()
![]()
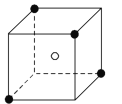
![]() 某离子晶体晶胞的结构如图1所示,
某离子晶体晶胞的结构如图1所示,![]() 位于立方体中心,
位于立方体中心,![]() 位于立方体顶点。该晶体的化学式为______
位于立方体顶点。该晶体的化学式为______
A.![]()
![]() C.
C.![]()
![]()
![]() 下列物质性质的变化规律与键能无关的是______
下列物质性质的变化规律与键能无关的是______
A.热稳性:![]()
B.熔、沸点:金刚石![]() 晶体硅
晶体硅
C.熔点:![]()
D.熔、沸点:![]()
![]() 、S、Se是同一主族元素,请回答下列问题:
、S、Se是同一主族元素,请回答下列问题:
![]() 、S、Se的电负性由大到小的顺序是______。
、S、Se的电负性由大到小的顺序是______。
![]() 是______分子
是______分子![]() 填“极性”或“非极性”
填“极性”或“非极性”![]() ,中心原子的轨道杂化类型为______,
,中心原子的轨道杂化类型为______,![]() 分子的立体构型名称是______。
分子的立体构型名称是______。
![]() 的沸点高于
的沸点高于![]() 的沸点,其原因是______。
的沸点,其原因是______。
![]() 与
与![]() 分子互为等电子体的阴离子为______
分子互为等电子体的阴离子为______![]() 填化学式
填化学式![]() 。
。
![]() 已知Se原子比O原子多2个电子层,基态Se原子核外电子排布式为______,有______个未成对电子。
已知Se原子比O原子多2个电子层,基态Se原子核外电子排布式为______,有______个未成对电子。
![]() 离化合物
离化合物![]() 的晶胞如图所示,
的晶胞如图所示,![]() 的配位数是______;若阿伏加德罗常数值为
的配位数是______;若阿伏加德罗常数值为![]() ,晶胞参数为anm,列式计算晶体的密度
,晶胞参数为anm,列式计算晶体的密度![]() ______
______![]() 只列式,不用计算最后结果
只列式,不用计算最后结果![]() 。
。
查看答案和解析>>
科目: 来源: 题型:
【题目】用多孔石墨电极完成下列实验:
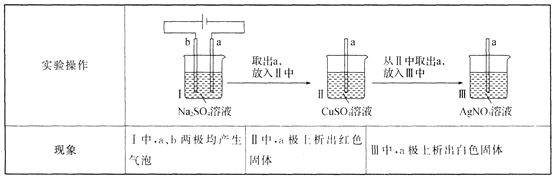
下列对实验现象的解释或推测不合理的是 ( )
A.I中,b极反应:2H2O-4e-=== O2↑+4 H+
B.Ⅱ中,析出红色固体:Cu2++H2 === Cu+2H+
C.Ⅲ中,只可能发生反应:2Ag++Cu === Cu2++2Ag
D.I中,a极上既发生了化学过程,也发生了物理过程
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下进行反应:COCl2(g)![]() Cl2 (g)+CO(g)。向2.0 L恒容密闭容器中充入1.0 mol COCl2 (g),经过一段时间后达到平衡。反应过程中测得的有关数据见下表:
Cl2 (g)+CO(g)。向2.0 L恒容密闭容器中充入1.0 mol COCl2 (g),经过一段时间后达到平衡。反应过程中测得的有关数据见下表:
t/s | 0 | 2 | 4 | 6 | 8 |
n(Cl2) /mol | 0 | 0.30 | 0.39 | 0.40 | 0.40 |
下列说法正确的是 ( )
A.保持其他条件不变,升高温度,平衡时c(Cl2) = 0.22 mol·L-1,则反应的 △H < 0
B.若在2 L恒容绝热(与外界没有热量变换)密闭容器进行该反应,化学平衡常数不变
C.保持其他条件不变,起始向容器中充入1.2 mol COCl2、0.60 mol Cl2和0.6 mol CO,反应达到平衡前的速率:v (正) > v (逆)
D.保持其他条件不变,起始向容器中充入1.0 mol Cl2和0.8 mol CO,达到平衡时,Cl2的转化率小于60%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com