
科目: 来源: 题型:
【题目】坦桑石是一种世界公认的新兴宝石,这种宝石于1967年首次在赤道雪山脚下的阿鲁沙地区被发现。坦桑石的主要化学成分为![]() ,还可含有V、Cr、Mn等元素。
,还可含有V、Cr、Mn等元素。
![]() 下列状态的铝中,电离最外层的一个电子所需能量最大的是________
下列状态的铝中,电离最外层的一个电子所需能量最大的是________![]() 填序号
填序号![]() 。
。
①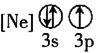 ②
②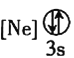 ③
③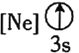 ④
④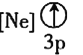
![]() 烟酸铬是铬的一种化合物,其合成过程如下:
烟酸铬是铬的一种化合物,其合成过程如下:
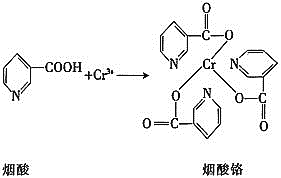
![]() 核外电子排布式为________。
核外电子排布式为________。
![]() 、C、N、O的电负性由大到小的顺序是_________。
、C、N、O的电负性由大到小的顺序是_________。
![]() 烟酸中碳、氮原子的杂化方式分别为________、________。
烟酸中碳、氮原子的杂化方式分别为________、________。
![]() 分子中的大
分子中的大![]() 键可用符号
键可用符号![]() 表示,其中m代表参与形成大
表示,其中m代表参与形成大![]() 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大![]() 键的电子数
键的电子数![]() 如二氧化碳分子中的大
如二氧化碳分子中的大![]() 键可表示为
键可表示为![]() ,则烟酸中的大
,则烟酸中的大![]() 键应表示为___________。
键应表示为___________。
![]() 、
、![]() 都极易水解。
都极易水解。![]() 、
、![]() 都属于______
都属于______![]() 填“极性”或“非极性”
填“极性”或“非极性”![]() 分子,其熔点的关系为
分子,其熔点的关系为![]() ________
________![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() 。
。
![]() 将Mn掺入GaAs晶体
将Mn掺入GaAs晶体![]() 图甲
图甲![]() 可得到稀磁性半导体材料
可得到稀磁性半导体材料![]() 图乙
图乙![]() ,图甲、图乙晶体结构不变。
,图甲、图乙晶体结构不变。
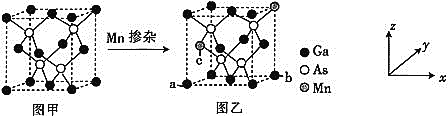
![]() 图乙中a点和b点的原子坐标参数分别为
图乙中a点和b点的原子坐标参数分别为![]() 0,
0,![]() 和
和![]() 1,
1,![]() ,则c点的原子坐标参数为________。
,则c点的原子坐标参数为________。
![]() 设图甲晶体的密度为
设图甲晶体的密度为![]() ,用
,用![]() 表示阿伏加德罗常数的数值,则该晶胞中距离最近的两个镓原子之间的距离为________________pm。
表示阿伏加德罗常数的数值,则该晶胞中距离最近的两个镓原子之间的距离为________________pm。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上苯乙烯是合成树脂、离子交换树脂及合成橡胶等的重要单体,如图是苯乙烯的结构简式:![]() ,下列关于该有机物的说法不正确的是( )
,下列关于该有机物的说法不正确的是( )
A. 苯乙烯的分子式为C8H8
B. 苯乙烯通过加聚反应可制备高分子化合物
C. 苯乙烯与溴的四氯化碳溶液反应:![]()
D. 苯乙烯能发生加成反应,但不能发生取代反应
查看答案和解析>>
科目: 来源: 题型:
【题目】2017年5月18日中国地质调查局宣布,我国在南海进行的可燃冰试采获得成功,成为全球第一个获得可燃冰连续稳定产气的国家。可燃冰是天然气与水相互作用形成的晶体物质,主要存在于冻土层和海底大陆架中。下列说法正确的是( )

①甲烷属于烃类;②相同条件下,甲烷的密度大于空气的密度;③甲烷难溶于水;④可燃冰是一种极具潜力的能源;⑤青藏高原可能存在巨大体积的“可燃冰”
A.①③④⑤B.②③④⑤C.①②③⑤D.①②④⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:KSP(BaSO4)=2×10-10,KSP(BaSO3)=2.5×10-7,现有一Na2SO4、Na2SO3的混合溶液,其中c(Na2SO3)=0.5mol/L,c(Na2SO4)=0.05mol/L。若向该溶液中加入等体积的0.5mol/LBaCl2溶液,充分反应后,溶液中c(Ba2+)=__(混合时溶液体积变化忽略不计)。若向该混合溶液中加BaCl2固体,当SO32-开始沉淀时,c(SO42-)=___;当SO42-沉淀完全时,c(SO32-)=___。
查看答案和解析>>
科目: 来源: 题型:
【题目】连二次硝酸(H2N2O2)是一种二元酸,可用于制N2O气体。
(1)常温下,用0.01mol/L的NaOH溶液滴定10mL0.01mol/L的H2N2O2溶液,测得溶液pH与NaOH溶液体积的关系如图所示。
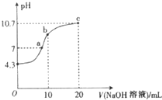
c点时溶液中各离子浓度由大到小的顺序为___;
②b点时溶液中c(N2O22-)___c(H2N2O2)(填“>”“<”或“=”);
(2)硝酸银溶液和连二次硝酸钠溶液混合,可以得到黄色的连二次硝酸银沉淀,向该分散系中滴加硫酸钠溶液,当白色沉淀和黄色沉淀共存时,分散系中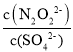 =___。
=___。
[已知KSP(Ag2SO4)=1.4×10-5、KSP(Ag2N2O2)=5.6×10-9 ]。
(3)常温下,向b mol/L醋酸钠溶液中滴加等体积的amol/L的盐酸,使溶液恰好呈中性,则醋酸的电离平衡常数=___(用含a、b的代数式表示)
查看答案和解析>>
科目: 来源: 题型:
【题目】纳米级Fe3O4呈黑色,因其有磁性且粒度小而在磁记录材料、生物功能材料等诸多领域有重要应用,探究其制备和用途意义重大。
(1)还原-沉淀法:①用还原剂Na2SO3将一定量Fe3+可溶盐溶液中的![]() Fe3+还原,使Fe2+和Fe3+的物质的量比为1 : 2。②然后在①所得体系中加入氨水,铁元素完全沉淀形成纳米Fe3O4。写出②过程的离子方程式:__________。
Fe3+还原,使Fe2+和Fe3+的物质的量比为1 : 2。②然后在①所得体系中加入氨水,铁元素完全沉淀形成纳米Fe3O4。写出②过程的离子方程式:__________。
(2)电化学法也可制备纳米级Fe3O4,用面积为4 cm2的不锈钢小球(不含镍、铬)为工作电极,铂丝作阴极,用Na2SO4溶液作为电解液,电解液的pH维持在10左右,电流50 mA。生成Fe3O4的电极反应为______。
(3)已知:H2O(1) === H2(g)+![]() O2(g) △H =+285.5 kJ·mol-l,以太阳能为热源分解Fe3O4,经由热化学铁氧化合物循环分解水制H2的过程如下,完善以下过程I的热化学方程式。过程I:__________。过程Ⅱ:3FeO(s)+H2O(l) === H2(g)+Fe3O4(s) △H =+128.9 kJ·mol-1
O2(g) △H =+285.5 kJ·mol-l,以太阳能为热源分解Fe3O4,经由热化学铁氧化合物循环分解水制H2的过程如下,完善以下过程I的热化学方程式。过程I:__________。过程Ⅱ:3FeO(s)+H2O(l) === H2(g)+Fe3O4(s) △H =+128.9 kJ·mol-1
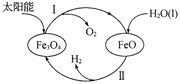
(4)磁铁矿(Fe3O4)常作冶铁的原料,主要反应为Fe3O4(s)+4CO(g)![]() 3Fe(s)+4CO2 (g),该反应的△H < 0,T℃时,在1 L恒容密闭容器中,加入Fe3O4、CO各0.5 mol,10 min后反应达到平衡时,容器中CO2的浓度是0.4 mol·L-1。
3Fe(s)+4CO2 (g),该反应的△H < 0,T℃时,在1 L恒容密闭容器中,加入Fe3O4、CO各0.5 mol,10 min后反应达到平衡时,容器中CO2的浓度是0.4 mol·L-1。
①T℃时,10 min内用Fe3O4表示的平均反应速率为___g·min-1。
②T℃时,该反应的平衡常数为____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】若20g密度为ρg·cm-3的Ca(NO3)2溶液中含有2gCa(NO3)2,则溶液中![]() 的物质的量浓度为
的物质的量浓度为
A.![]() mol·L-1B.
mol·L-1B.![]() mol·L-1C.
mol·L-1C.![]() mol·L-1D.
mol·L-1D.![]() mol·L-1
mol·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】用向下排气法在容积为VmL的集气瓶中收集氨气,由于空气尚未排净,最后瓶内气体相对于氢气的密度为9.5,将此盛满气体的集气瓶倒置于水中,瓶内水马上升到一定高度后,即停止上升,则在同温同压下,瓶内剩余气体的体积为
A.![]() VmLB.
VmLB.![]() mLC.
mLC.![]() mLD.无法判断
mLD.无法判断
查看答案和解析>>
科目: 来源: 题型:
【题目】氮元素有着多变价态和种类繁多的化合物,在工农业生产中有重要的应用。
![]() 同周期元素中,比氮元素的第一电离能大的元素共有________种。
同周期元素中,比氮元素的第一电离能大的元素共有________种。
![]() 与汞共热可制得
与汞共热可制得![]() 。
。
![]() 的几何构型为________,
的几何构型为________,![]() 中
中![]() 键和
键和![]() 键的个数比为________。
键的个数比为________。
![]() 已知汞位于第六周期,与锌同族。基态汞原子的价电子排布式为______。
已知汞位于第六周期,与锌同族。基态汞原子的价电子排布式为______。
![]() 分子中B原子的杂化轨道类型为_______,该分子的熔沸点比乙烷高,原因是________________。
分子中B原子的杂化轨道类型为_______,该分子的熔沸点比乙烷高,原因是________________。
![]() 由B、N、F元素组成的离子化合物中,B、N、F原子的个数比为
由B、N、F元素组成的离子化合物中,B、N、F原子的个数比为![]() ,其阴阳离子是等电子体,该化合物中的阴离子是________
,其阴阳离子是等电子体,该化合物中的阴离子是________![]() 填离子符号
填离子符号![]() 。
。
![]() 氮化硼晶体结构如图所示:
氮化硼晶体结构如图所示:
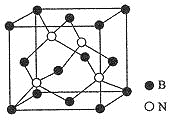
![]() 该晶体中含有的微粒间作用力为________。
该晶体中含有的微粒间作用力为________。
![]() 图中N原子的坐标参数为
图中N原子的坐标参数为![]() ;
;![]() ;
;![]() ;________。
;________。
![]() 已知BN晶胞中相邻且最近的硼、氮原子的核间距为acm,
已知BN晶胞中相邻且最近的硼、氮原子的核间距为acm,![]() 为阿伏加德罗常数的值,其密度为________
为阿伏加德罗常数的值,其密度为________![]() 列出计算式即可
列出计算式即可![]() 。
。
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法不正确的是
A.一定条件下,合成氨反应中有0.5molN2发生反应,则反应中转移电子数为3NA
B.10克环己烷与2-丙醇的混合液中,碳元素的质量分数为72%,则其中所含的氧原子数目为![]() NA
NA
C.12g石墨中含有3NA个C-C共价键
D.常温常压下有28g单晶硅晶体,则其中所含的Si﹣Si键数目为2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com