
科目: 来源: 题型:
【题目】某同学为检验某溶液中是否含有常见的四种无机离子,进行了如图所示的实验操作.其中检验过程中产生的气体能使湿润的红色石蕊试纸变蓝.由该实验能得到的正确结论是![]()
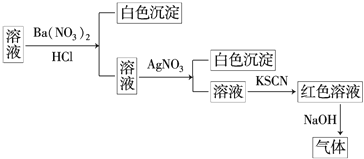
A.原溶液中一定含有![]() B.原溶液中一定含有
B.原溶液中一定含有![]()
C.原溶液中一定含有![]() D.原溶液中一定含有
D.原溶液中一定含有![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:![]() 微溶于水,可溶于硝酸。溶液X中可能含有
微溶于水,可溶于硝酸。溶液X中可能含有![]() 中的几种离子。为了确定其组成,某同学进行了如下实验:
中的几种离子。为了确定其组成,某同学进行了如下实验:
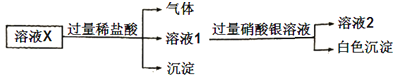
下列说法正确的是( )
A.溶液X中一定含有![]()
![]() 和
和![]()
B.溶液X中一定不含![]() 、
、![]()
C.为确定溶液X中是否含有![]() ,可取溶液2,加入
,可取溶液2,加入![]() 溶液
溶液
D.在溶液X中依次滴入盐酸、双氧水和硫氰化钾溶液后,溶液将变为红色
查看答案和解析>>
科目: 来源: 题型:
【题目】现有A、B、C、D、E五种均可溶于水的固体物质,是由以下提供的几种离子组成![]() 每种离子只能用一次
每种离子只能用一次![]() :
:
阳离子 |
|
阴离子 |
|
现分别进行如下实验:
![]() 将D与E的溶液混合加热,产生有刺激性气味的气体
将D与E的溶液混合加热,产生有刺激性气味的气体
![]() 将B与E的溶液混合,产生白色沉淀,向该沉淀中加入足量的稀硝酸,沉淀部分溶解
将B与E的溶液混合,产生白色沉淀,向该沉淀中加入足量的稀硝酸,沉淀部分溶解
![]() 在常温下用pH试纸测定溶液A的
在常温下用pH试纸测定溶液A的![]()
下列说法不正确的是![]()
A.物质E的化学式为![]() B.物质D中一定含有
B.物质D中一定含有![]()
C.难以确定物质A的组成D.物质C的化学式是![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是模拟“侯氏制碱法”制取NaHCO3的部分装置。下列操作正确的是( )

A. a通入CO2,然后b通入NH3,c中放碱石灰
B. b通入NH3,然后a通入CO2,c中放碱石灰
C. a通入NH3,然后b通入CO2,c中放蘸稀硫酸的脱脂棉
D. b通入CO2,然后a通入NH3,c中放蘸稀硫酸的脱脂棉
查看答案和解析>>
科目: 来源: 题型:
【题目】某无色溶液中可能含有Ba2+、Fe3+、Na+、K+、![]() 、
、![]() 、
、![]() 、Cl-、Br-、
、Cl-、Br-、![]() 中的若干种,离子浓度都为0.1mol/L,往该溶液中加入BaCl2和过量的盐酸,无白色沉淀生成。另取少量原溶液,设计并完成如下实验。下列判断正确的是( )
中的若干种,离子浓度都为0.1mol/L,往该溶液中加入BaCl2和过量的盐酸,无白色沉淀生成。另取少量原溶液,设计并完成如下实验。下列判断正确的是( )
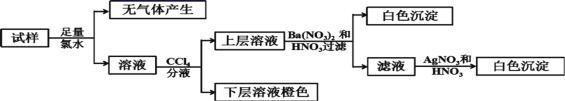
A.Ba2+、Fe3+、![]() 、
、![]() 肯定不存在,Na+、K+肯定存在
肯定不存在,Na+、K+肯定存在
B.原溶液肯定不含![]() 和
和![]()
C.若步骤中Ba(NO3)2和HNO3溶液改用BaCl2和盐酸的混合溶液,对溶液中离子的判断有影响
D.是否含![]() 需另做实验判断
需另做实验判断
查看答案和解析>>
科目: 来源: 题型:
【题目】电离平衡常数是衡量弱电解质电离程度的物理量。
I.已知:
化学式 | 电离常数(25 ℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
(1)25 ℃时,有等浓度的NaCN溶液、Na2CO3溶液和CH3COONa溶液,三溶液的pH由大到小的顺序为________(用化学式表示)。
(2)向NaCN溶液中通入少量的CO2,发生反应的化学方程式__________________。
(3)25 ℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=________ mol·L-1(填精确值),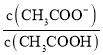 =_____。
=_____。
П.常温下有0.1 mol/L的以下几种溶液,①H2SO4溶液,②NaHSO4溶液,③CH3COOH溶液,④HCl溶液,⑤HCN溶液,⑥NH3·H2O,其中如下几种溶液的电离度(即已经电离的占原来总的百分数)如下表(已知H2SO4的第一步电离是完全的),回答下面问题:

(4)常温下,pH相同的表格中几种溶液,其物质的量浓度由大到小的顺序是(填序号,下同)________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.制取Fe(OH)3胶体:Fe3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
B.锅炉除水垢时先用纯碱浸泡:CaSO4+CO32-=CaCO3+SO42-
C.泡沫灭火器灭火原理:2Al3++3CO32-+3H2O =2Al(OH)3↓+3CO2↑
D.碳酸钠溶液显碱性:CO32-+2H2OH2CO3+2OH-
查看答案和解析>>
科目: 来源: 题型:
【题目】我国航天航空事业蒸蒸日上,航天航空的关键技术是火箭,火箭燃料有液氢、乙炔![]() 、甲烷、煤油、肼
、甲烷、煤油、肼![]() 等。请回答下列问题:
等。请回答下列问题:
(1)已知肼的结构简式可表示为![]() 。
。
①肼分子中的化学键类型为 _______________________。
②肼在氧气中燃烧生成无毒的物质,则反应中肼断裂的化学键有N—H键、_______________________,新形成的化学键有_______________________ 。
③根据肼燃烧过程中的能量变化,说明反应物能量之和_______________________ (填“大于”“等于”或“小于”)生成物能量之和。
(2)氢燃料汽车中氢的燃烧与火箭中氢的燃烧最大的不同在于前者使用的是空气作氧化剂,而后者使用的是液氧。火箭中不能使用液化空气,原因是_______________________ 。
(3)火箭发射前,当液氢、液氧加到一定量后,技术人员还要不停地补加,请你说出这种做法的原因_______________________ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】用零价铁![]() 去除水体中的硝酸盐
去除水体中的硝酸盐![]() 已成为环境修复研究的热点之一.
已成为环境修复研究的热点之一.
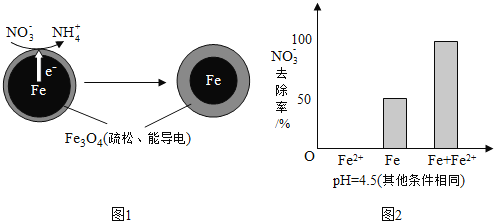
![]() 还原水体中
还原水体中![]() 的反应原理如图1所示.
的反应原理如图1所示.
①作负极的物质是______.
②正极的电极反应式是______.
![]() 将足量铁粉投入水体中,经24小时测定
将足量铁粉投入水体中,经24小时测定![]() 的去除率和pH,结果如下:
的去除率和pH,结果如下:
初始pH |
|
|
| 接近 |
|
24小时pH | 接近中性 | 接近中性 |
铁的最终物质形态 |
|
|
![]() 时,
时,![]() 的去除率低.其原因是______.
的去除率低.其原因是______.
![]() 实验发现:在初始
实验发现:在初始![]() 的水体中投入足量铁粉的同时,补充一定量的
的水体中投入足量铁粉的同时,补充一定量的![]() 可以明显提高
可以明显提高![]() 的去除率.对
的去除率.对![]() 的作用提出两种假设:
的作用提出两种假设:
Ⅰ![]() 直接还原
直接还原![]() ;
;
Ⅱ![]() 破坏
破坏![]() 氧化层.
氧化层.
①做对比实验,结果如图2所示,可得到的结论是______.
②同位素示踪法证实![]() 能与
能与![]() 反应生成
反应生成![]() 结合该反应的离子方程式,解释加入
结合该反应的离子方程式,解释加入![]() 提高
提高![]() 去除率的原因:______.
去除率的原因:______.
![]() 其他条件与
其他条件与![]() 相同,经1小时测定
相同,经1小时测定![]() 的去除率和pH,结果如表:
的去除率和pH,结果如表:
初始pH |
|
|
| 约 | 约 |
1小时pH | 接近中性 | 接近中性 |
与![]() 中数据对比,解释
中数据对比,解释![]() 中初始pH不同时,
中初始pH不同时,![]() 去除率和铁的最终物质形态不同的原因:______.
去除率和铁的最终物质形态不同的原因:______.
查看答案和解析>>
科目: 来源: 题型:
【题目】氯化铁是常见的水处理剂。某氯化铁(FeCl36H2O)样品含有少量FeCl2杂质。现要测定其中FeCl36H2O的质量分数,实验按以下步骤进行:
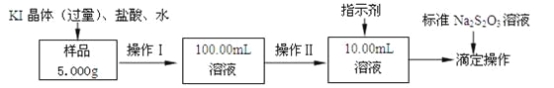
已知有关离子方程式为:2Fe3++2I-═2Fe2++I2,I2+2S2O32-═2I-+S4O62-
(1)取少量氯化铁样品滴入50mL沸水中,加热片刻,液体呈现红褐色,反应的离子方程式为:________________________。
(2)操作I所用到的玻璃仪器除烧杯、玻璃棒外,还必须有________、_________(填仪器名称)。
(3)操作II必须用到的仪器是________(选填编号);
a.50mL烧杯 b.10mL量筒 c.20mL量筒 d.25mL滴定管
指示剂是淀粉溶液,则达到滴定终点的现象是__________________________。
(4)滴定时,消耗浓度为0.1000mol/L的标准Na2S2O3溶液18.00mL。该样品中FeCl36H2O(式量为270.5)的质量分数为_____________。
(5)要把样品氯化铁中的少量FeCl2杂质除去,可用的试剂是________(选填编号)。
a.铁粉 b.氯水 c.溴水 d.双氧水
(6)如果采用以下步骤测定氯化铁样品元素的含量,完成下列填空。
①称量样品 ②加水溶解 ③加足量氨水,沉淀 ④过滤 ⑤灼烧 ⑥称量并进行恒重操作。
还缺少的一步操作是________;在过滤前,需要检验是否沉淀完全,其操作___________________;判断是否恒重的标准是_________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com