
科目: 来源: 题型:
【题目】醇脱水是合成烯烃的常用方法,实验室用环己醇合成环己烯的反应实验装置如图所示:
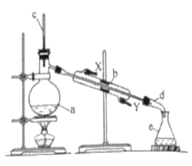
可能用到的有关数据如下:

(1)仪器a的名称为_____,向仪器a中加入①环己醇②浓硫酸③碎瓷片的合理顺序为_____(填序号),碎瓷片的作用是_____。
(2)装置b中冷凝水应从_____口进入;该反应温度计的数值控制不超过90℃,温度计水银球放在支管口处的目的是____。
(3)由环己醇制取环己烯的方程式_____,实验中最容易产生的副产物的结构简式为____。
(4)分离提纯时,将生成粗产品倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后再加入无水氯化钙颗粒。分液漏斗在使用前须清洗干净并_____,向分液漏斗中粗产品加入5%碳酸钠溶液后的分离操作过程是_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上电解精炼铜的阳极泥是重要的二次资源,从阳极泥(含铜、银、金、铅等单质)中提取金和制备AgCl的工艺如下:

已知:分金液的主要成分为H[AuCl4];分金渣的主要成分为PbSO4和AgCl;分银液的主要成分为[Ag(SO3)2]3-,且存在[Ag(SO3)2]3-![]() Ag++2SO32-
Ag++2SO32-
回答下列问题:
(1)“分铜”时,铜单质参与反应的离子方程式为___________;如果温度过高,铜的浸出率会降低,原因是____________。
(2)“分铜渣”中的成分有Au、Ag、AgCl和__________。
(3)“分金”时,溶解单质金的化学方程式为________;除HC1、NaC1O3可溶解金外,“王水”也可溶解金,“王水”的成分为_____________(写试剂的名称)。
(4)从“分金液”中提取金时,氧化剂和还原剂的物质的量之比为_______________。
(5)向“分银液”中加入适量的H2SO4调到pH=4时“沉银”,能够析出AgCl的原因是___________。
(6)AgCl能溶于氨水,发生反应AgCl(s)+2NH3(aq)![]() [Ag(NH3)2](aq))+Cl-(aq),其平衡常数K=2.0×10-3,现用1L某浓度氨水(溶质视为NH3)完全溶解0.1mol AgCl,所需氨水浓度至少为____________mol·L-1(已知
[Ag(NH3)2](aq))+Cl-(aq),其平衡常数K=2.0×10-3,现用1L某浓度氨水(溶质视为NH3)完全溶解0.1mol AgCl,所需氨水浓度至少为____________mol·L-1(已知![]() =2.25)。
=2.25)。
查看答案和解析>>
科目: 来源: 题型:
【题目】自然界存在的元素中,金属元素种类更多,非金属元素丰度更大。
Ⅰ.80%左右的非金属元素在现代技术包括能源、功能材料等领域占有极为重要的地位。
(1)氮及其化合物与人类生产、生活息息相关,基态N原子的价电子排布图是_____________,N2F2分子中N原子的杂化方式是_______,1 mol N2F2含有________个σ键。
(2)高温陶瓷材料Si3N4晶体中键角N-Si-N____(填“>”、“<”或“=”)Si-N-Si,原因_________。
Ⅱ.金属元素在现代工业中也占据极其重要的地位。其中钛也被称为“未来的钢铁”,具有质轻、抗腐蚀、硬度大,是宇航、航海、化工设备等的理想材料,是一种重要的战略资源,越来越受到各国的重视。
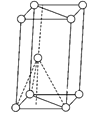
(3)基态钛原子核外共有________种运动状态不相同的电子。金属钛晶胞如下图所示,为________(填堆积方式)堆积。
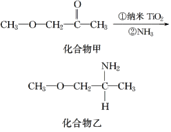
(4)纳米TiO2是一种应用广泛的催化剂,其催化的一个实例如图。化合物乙的沸点明显高于化合物甲,主要原因是__________。化合物乙中采取sp3杂化的原子的电负性由大到小的顺序为__________________。
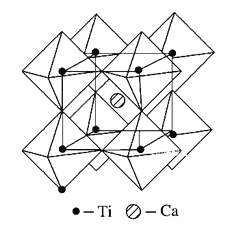
(5)钙钛矿晶体的结构如图所示。假设把氧离子看作硬球接触模型,钙离子和钛离子填充氧离子的空隙,氧离子形成正八面体,钛离子位于正八面体中心,钙离子位于立方晶胞的体心,一个钙离子被________个氧离子包围。钙钛矿晶体的化学式为________。若氧离子半径为a pm,则钙钛矿晶体中两个钛离子间最短距离为_______pm。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列不能用平衡移动原理解释的是( )
A.新制氯水中加入CaCO3固体可增大HClO分子的浓度
B.钢铁在潮湿的空气中比在干燥空气中更容易生锈
C.通入过量的空气与SO2反应可以提高SO2的利用率
D.由NO2和N2O4组成的平衡体系加压后颜色先变深后变浅
查看答案和解析>>
科目: 来源: 题型:
【题目】某学生用0.2000mol/L的NaOH标准溶液滴定未知浓度的盐酸,其操作可分为如下几步:
A、量取20.0ml待测盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞;
B、用标准溶液润洗滴定管2-3次;
C、取盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液;
D、取标准NaOH溶液注入碱式滴定管至刻度线0以上2cm-3cm;
E、调节液面至“0”或“0”以下刻度并记下读数;
F、把锥形瓶放在滴定管的下面,用NaOH溶液滴定至终点并记下滴定管液面的刻度
据此实验完成填空:
(1)正确操作步骤的顺序是___。(用序号字母填写)
(2)用标准的NaOH溶液滴定待测盐酸时,左手握碱式滴定管的带有玻璃球的橡胶管部分,右手摇动锥形瓶,眼睛注视___。判断滴定终点的方法是___。
(3)某学生根据3次实验分别记录有关数据如表:
滴定 次数 | 待测液 体积(mL) | 标准NaOH溶液体积(mL) | |
滴定前读数(mL) | 滴定后读数(mL) | ||
1 | 20.00 | 1.02 | 21.03 |
2 | 20.00 | 2.00 | 21.99 |
3 | 20.00 | 1.20 | 23.20 |
①根据上述数据,可计算出该盐酸的浓度为___(保留两位有效数字).
②在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有___(填字母序号)
A.滴定终点读数时俯视读数
B.碱式滴定管使用前,水洗后未用待测盐酸润洗
C.锥形瓶水洗后未干燥
D.碱式滴定管尖嘴部分有气泡,滴定后消失
查看答案和解析>>
科目: 来源: 题型:
【题目】某溶液可能含![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的几种离子.为了确定其成分,设计了如下实验;
中的几种离子.为了确定其成分,设计了如下实验;
![]() 取少量溶液于试管,滴加盐酸,观察到有大量气泡逸出,得到透明溶液;
取少量溶液于试管,滴加盐酸,观察到有大量气泡逸出,得到透明溶液;
![]() 在
在![]() 反应后的溶液中滴加硝酸银溶液,产生白色沉淀.
反应后的溶液中滴加硝酸银溶液,产生白色沉淀.
下列推断正确的是![]()
A.溶液中一定含![]() 、
、![]()
B.溶液中可能含![]() 、
、![]() 、
、
C.溶液中一定含![]() 、
、![]()
D.溶液中一定不含![]() 、
、![]() 、
、![]() 、
、
查看答案和解析>>
科目: 来源: 题型:
【题目】在某钠盐溶液中,除![]() 之外可能还含有等物质的量的下列阴离子中的一种或多种:
之外可能还含有等物质的量的下列阴离子中的一种或多种:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 。在此溶液中加入过量盐酸,产生气泡,溶液颜色变深,但仍澄清,并且原溶液中的阴离子种类减少了3种。关于此溶液,下列说法正确的是
。在此溶液中加入过量盐酸,产生气泡,溶液颜色变深,但仍澄清,并且原溶液中的阴离子种类减少了3种。关于此溶液,下列说法正确的是![]()
A.原溶液中可能含有![]()
B.生成的气体中一定有NO,可能含有![]()
C.溶液中减少的离子是![]() 、
、![]() 、
、![]()
D.原溶液中一定含有![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】铝是应用广泛的金属。以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料制备铝的一种工艺流程如下:

注:SiO2在“碱溶”时转化为铝硅酸钠沉淀。
(1)“碱溶”时生成偏铝酸钠的离子方程式为_____________________。
(2)向“过滤Ⅰ”所得滤液中加入NaHCO3溶液,溶液的pH_________ (填“增大”、“不变”或“减小”)。
(3)“电解Ⅰ”是电解熔融Al2O3,电解过程中作阳极的石墨易消耗,原因是___________。
(4)“电解Ⅱ”是电解Na2CO3溶液,原理如图所示。阳极的电极反应式为_____________________,阴极产生的物质A的化学式为____________。
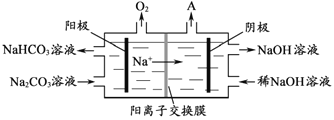
(5)铝粉在1000℃时可与N2反应制备AlN。在铝粉中添加少量NH4Cl固体并充分混合,有利于AlN的制备,其主要原因是_____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】精神病学专家通过实验发现“快乐机理”:在大脑的相应部位—“奖赏中心”,给予柔和的电击,便会处于似乎极度快乐的状态。人们已经将“奖赏中心”各部分的脑电图绘制出来,并认为,在各区域之间传递信息的化学物质是多巴胺,所以“奖赏中心”又称为多巴胺系统。多巴胺结构如图:
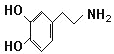
(1)多巴胺分子式:_____。
(2)试判断多巴胺能发生的化学反应_____。
A.加成 B.取代 C.氧化 D.水解
(3)写出所有符合下列条件的与多巴胺互为同分异构体的物质的结构简式____。
①属于1、3、5三取代苯
②苯环上直接连有一个羟基和一个氨基
③分别能与钠和氢氧化钠反应,消耗钠与氢氧化钠的物质的量之比为2:1
(4)多巴胺可由香兰素与硝基甲烷发生系列反应而得。合成过程表示如图:
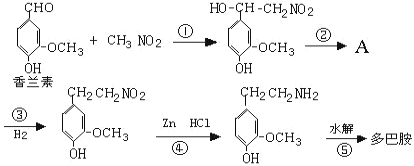
Ⅰ.写出下列反应类型:反应①___,反应④___。
Ⅱ.写出②的化学方程式:___。
查看答案和解析>>
科目: 来源: 题型:
【题目】高锰酸钾![]() 是一种常用氧化剂,主要用于化工、防腐及制药工业等。以软锰矿
是一种常用氧化剂,主要用于化工、防腐及制药工业等。以软锰矿![]() 主要成分为
主要成分为![]() 为原料生产高锰酸钾的工艺路线如下:
为原料生产高锰酸钾的工艺路线如下:
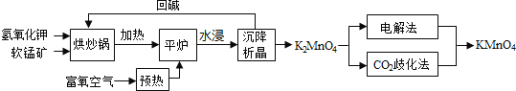
回答下列问题:
![]() 原料软锰矿与氢氧化钾按1:1的比例在“烘炒锅”中混配,混配前应将软锰矿粉碎,其作用是 __________________________________________;
原料软锰矿与氢氧化钾按1:1的比例在“烘炒锅”中混配,混配前应将软锰矿粉碎,其作用是 __________________________________________;
![]() “平炉”中发生的化学方程式为 _______________________________;
“平炉”中发生的化学方程式为 _______________________________;
![]() “平炉”中需要加压,其目的是 _______________________________;
“平炉”中需要加压,其目的是 _______________________________;
![]() 将
将![]() 转化为
转化为![]() 的生产有两种工艺:
的生产有两种工艺:
![]() “
“![]() 歧化法”是传统工艺,即在
歧化法”是传统工艺,即在![]() 溶液中通入
溶液中通入![]() 气体,使体系呈中性或弱酸性,
气体,使体系呈中性或弱酸性,![]() 发生歧化反应,反应中生成
发生歧化反应,反应中生成![]() ,
,![]() 和 __________________
和 __________________![]() 写化学式
写化学式![]() ;
;
![]() “电解法”为现代工艺,即电解
“电解法”为现代工艺,即电解![]() 水溶液,电解槽中阳极发生的电极反应为______________________________________________;
水溶液,电解槽中阳极发生的电极反应为______________________________________________;
![]() “电解法”和“
“电解法”和“![]() 歧化法”中,
歧化法”中,![]() 的理论利用率之比为______;
的理论利用率之比为______;
![]() 高锰酸钾纯度的测定:称取
高锰酸钾纯度的测定:称取![]() 样品,溶解后定容于100mL容量瓶中,摇匀。取浓度为
样品,溶解后定容于100mL容量瓶中,摇匀。取浓度为![]() 的
的![]() 标准溶液
标准溶液![]() ,加入稀硫酸酸化,用
,加入稀硫酸酸化,用![]() 溶液平行滴定三次,平均消耗的体积为
溶液平行滴定三次,平均消耗的体积为![]() ,该样品的纯度为_____________
,该样品的纯度为_____________![]() 列出计算式即可,已知
列出计算式即可,已知![]() 。
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com