
科目: 来源: 题型:
【题目】2019年是门捷列夫提出元素周期表150周年。根据元素周期律和元素周期表,下列推断不合理的是( )
A.C的非金属性强于Si,CH4的沸点高于SiH4
B.![]() 与
与![]() 得电子能力相同
得电子能力相同
C.短周期元素中原子半径最大的为Na
D.同族元素的原子化学性质相似,同族元素原子间可能形成离子化合物
查看答案和解析>>
科目: 来源: 题型:
【题目】将①H+、②Cl-、③Al3+、④K+、⑤S2-、⑥OH-、⑦NO3-、⑧NH4+分别加入H2O中,基本上不影响水的电离平衡的离子是( )
A.①③⑤⑦⑧B.②④⑥⑧C.①⑥D.②④⑦
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是( )
A.无色透明的溶液中:K+、Cr2O72-、Cl-、H+
B.![]() =1×1012的溶液中:K+、Na+、CO32-、NO3-
=1×1012的溶液中:K+、Na+、CO32-、NO3-
C.c(SO32-)=0.1mol·L-1的溶液中:Na+、Cl-、H+、Ca2+
D.使pH试纸变红的溶液中:NH4+、Al3+、SO42-、Cl-
查看答案和解析>>
科目: 来源: 题型:
【题目】青蒿素是只含碳、氢、氧三元素的有机物,是高效的抗疟药,为无色针状晶体,易溶于乙醚中,在水中几乎不溶,熔点为156~157℃,已知乙醚沸点为35℃,从青蒿中提取青蒿素的方法之一是以萃取原理为基础,以乙醚浸取法的主要工艺如图所示:回答下列问题:
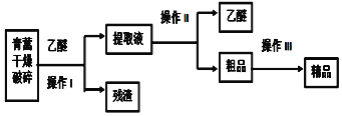
(1)选用乙醚浸取青蒿素的原因是______。
(2)操作Ⅰ需要的玻璃仪器主要有:烧杯、玻璃棒和______,操作Ⅱ的名称是______,操作Ⅲ利用青蒿素和杂质在同一溶剂中的溶解性差异及青蒿素溶解度随温度变化较大的原理提纯,这种方法是______。
(3)通常用燃烧的方法测定有机物的分子式,可在燃烧室内将有机物样品与纯氧在电炉加热下充分燃烧,根据产品的质量确定有机物的组成,如图所示的是用燃烧法确定青蒿素分子式的装置:
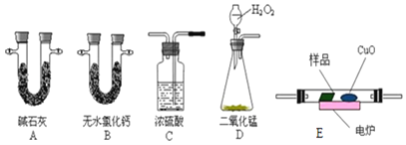
①按上述所给的测量信息,装置的连接顺序应是______。(装置可重复使用)
②青蒿素样品的质量为28.2g,用连接好的装置进行试验,称得A管增重66g,B管增重19.8g,则测得青蒿素的最简式是______。
③要确定该有机物的分子式,还必须知道的数据是______,可用______仪进行测定。
查看答案和解析>>
科目: 来源: 题型:
【题目】氮、铬及其相关化合物用途非常广泛。回答下列问题:
(1)基态N原子的核外电子排布式为_______________ ,Cr位于元素周期表第四周期____族。
(2)Cr与K位于同一周期且最外层电子数相同,两种元素原子第一电离能的大小关系为K___Cr(填“<”或“>”);
(3)CrCl3的熔点(83℃)比CrF3的熔点(1100℃)低得多,这是因为______________。
(4)Cr的一种配合物结构如图所示:
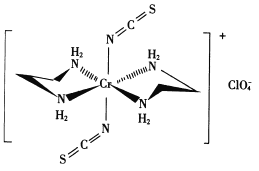
①阴离子C1O4-的空间构型为___________形。
②配离子中,中心离子的配位数为________。
(5)配体H2NCH2CH2NH2(乙二胺)中碳原子的杂化方式是_____________,分子中三种元素电负性从大到小的顺序为________________。
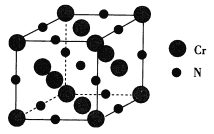
(6)氮化铬的熔点为1770℃,它的一种晶体的晶胞结构如图所示,其密度为5.9 g·cm-3,阿伏加德罗常数的值为6.02×1023,则氮化铬的晶胞边长为_________________nm(列出计算式).
查看答案和解析>>
科目: 来源: 题型:
【题目】在容积可变的密闭容器中存在如下反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH<0,下列分析中不正确的是( )
CO2(g)+H2(g) ΔH<0,下列分析中不正确的是( )

A. 图Ⅰ研究的是t0时升高温度对反应速率的影响
B. 图Ⅱ研究的是t0时增大压强(缩小容积)或使用催化剂对反应速率的影响
C. 图Ⅲ研究的是催化剂对化学平衡的影响,且甲使用了催化剂
D. 图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高
查看答案和解析>>
科目: 来源: 题型:
【题目】以铜为原料可制备应用广泛的氧化亚铜。
(1)向CuCl2溶液中通入SO2可得到CuCl沉淀,由CuCl水解再热分解可得到纳米Cu2O。CuCl水解为:CuCl(s)+H2O(l)![]() CuOH(s)+Cl-(aq)+H+(aq)。
CuOH(s)+Cl-(aq)+H+(aq)。
该反应的平衡常数K与此温度下KW、Ksp(CuOH)、Ksp(CuCl)的关系为K=____________。
(2)用铜作阳极,钛片作阴极,电解一定浓度的NaCl和NaOH的混合溶液可得到Cu2O,阳极及其溶液中有关转化如图所示。
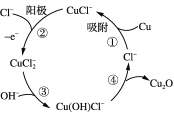
①阳极(反应②)的电极反应式为________________________________。
②电解一段时间后,电解液补充一定量的__________可完全恢复成原电解质溶液(填化学式)。
③溶液中③、④二步总反应的离子方程式为____________________________________。
(3)Cu2O与ZnO组成的催化剂可用于工业上合成甲醇: CO(g)+2H2(g)![]() CH3OH(g) ΔH=a kJ· mol-1。按n(H2)/n(CO)=2:1投料比将H2与CO充入V L恒容密闭容器中,在一定条件下发生反应,测定CO的平衡转化率与温度、压强的关系如图所示。
CH3OH(g) ΔH=a kJ· mol-1。按n(H2)/n(CO)=2:1投料比将H2与CO充入V L恒容密闭容器中,在一定条件下发生反应,测定CO的平衡转化率与温度、压强的关系如图所示。
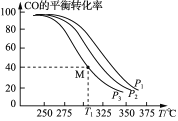
①该反应的ΔH_____0(填“<”或“>”),图中压强P1、P2、P3由大到小的关系是__________;
②起始时,甲容器中c(H2)=0.20 mol·L-1,c(CO)=0.10 mol·L-1,在P3及T1℃下反应达到平衡,此时反应的平衡常数为______(保留三位有效数字)。起始时,乙容器中c(H2)=0.40 mol·L-1,c(CO)=0.20 mol·L-1,T1℃下反应达到平衡,CO的平衡转化率______(填字母)。
A.大于40% B.小于40% C.等于40% D.等于80%
查看答案和解析>>
科目: 来源: 题型:
【题目】燃煤废气中的氮氧化物(NOx)、CO2、SO2等气体,常要采用不同方法处理,以实现节能减排、废物利用等。
(1)下列为二氧化硫和氮的氧化物转化的部分环节:
①已知:2SO2(g)+O2(g) 2SO3(g)△H=-196.6 kJmol-1
2NO(g)+O2(g) 2NO2(g)△H=-113.0 kJ·mol-1
则 SO2 气体与 NO2 气体反应生成 SO3 气体和 NO 气体的热化学方程式为 _______________。
②一定条件下,工业上可通过下列反应实现燃煤烟气中液态硫的回收,其中Y是单质: SO2(g)+2CO(g)![]() 2X(g)+Y(l)。为了测定在某种催化剂作用下的反应速率,某化学兴趣小组在某温度下、固定容器中用超灵敏气体传感器测得不同时间的 SO2 和 CO 浓度如下表:
2X(g)+Y(l)。为了测定在某种催化剂作用下的反应速率,某化学兴趣小组在某温度下、固定容器中用超灵敏气体传感器测得不同时间的 SO2 和 CO 浓度如下表:
时间/s | 0 | 1 | 2 | 3 | 4 |
c(SO2)/mol·L-1 | 1.00 | 0.50 | 0.23 | 3.00×10-37 | 3.00×10-37 |
c(CO)/mol·L-1 | 4.00 | 3.00 | 2.46 | 2.00 | 2.00 |
X的化学式为______;当时间为第4s时,v(SO2)正_____(填“>”“=”或“<”)v(X)逆。
(2)有科学家经过研究发现,在210~290℃、催化剂条件下用H2可将CO2转化生成甲醇蒸气和水蒸气。一定条件下,往2 L恒容密闭容器中充入 1 mol CO2 和 3.0 mol H2,在不同催化 剂作用下,相同时间内 CO2 的转化率随温度变化如图所示:
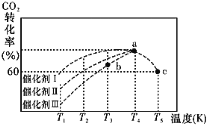
①催化剂效果最佳的是催化剂 _______(填“I”“II”或“III”)。
②此反应中a点的转化率比b点高的原因是__________________ 。 已知容器内的起始压强为100 kPa,则图中c点对应温度下反应的平衡常数 Kp=_____(保 留两位有效数字)(Kp为以分压表示的平衡常数,分压=总压×物质的量分数)。
查看答案和解析>>
科目: 来源: 题型:
【题目】过碳酸钠(2Na2CO3·3H2O2)广泛用于化工、造纸、纺织、食品等行业,一种以芒硝(Na2SO4·10H2O)、H2O2等为原料制备过碳酸钠的工艺流程如下:
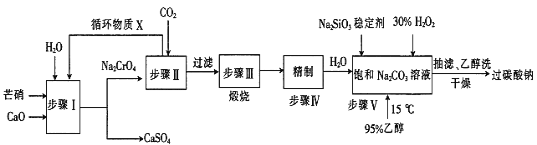
已知:2CrO42-+2H+![]() Cr2O72-+H2O,pH小于5时几乎均以Cr2O72-形式存在,pH大于8.5时几乎均以CrO42-形式存在。回答下列问题:
Cr2O72-+H2O,pH小于5时几乎均以Cr2O72-形式存在,pH大于8.5时几乎均以CrO42-形式存在。回答下列问题:
(1)由步骤I可知:Ksp(CaCrO4)_____Ksp(CaSO4)(填“>”或“<”)。
(2)流程中循环物质X的主要溶质为____________(填化学式)。
(3)步骤II后的溶液过滤得到一种酸式盐固体,其发生反应的离子方程式为________________。
(4)步骤III是为了制得纯碱,其化学方程式为 _________________________________。
(5)步骤V合成时,调节温度为15℃并加入95%乙醇的目的是____________________。
(6)测定产品活性氧的实验步骤如下:准确称取mg产品,用硫酸溶解后,用c mol· L-1的KMnO4标准溶液滴定至终点,消耗KMnO4标准溶液V mL。
①该滴定过程不需要外加指示剂的原因是_________________________________ 。
②滴定到终点时,溶液最终呈________(填“无色”或“浅红色”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】对如图结构的有机物的下列叙述中,不正确的是

A.常温下,能与Na2CO3溶液反应放出CO2气体
B.能发生碱性水解,lmol该有机物完成反应最多需消耗8molNaOH
C.与稀硫酸共热,生成两种有机物
D.该有机物的化学式是C14H10O9
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com