
科目: 来源: 题型:
【题目】电石法(乙炔法)制氯乙烯是最早完成工业化的生产氯乙烯的方法。
反应原理为HC≡CH+HCl![]() CH2=CHCl(HgCl2/活性炭作催化剂)。某学习小组的同学用下列装置测定该反应中乙炔的转化率(不考虑其他副反应)。铁架台及夹持仪器未画出。(已知
CH2=CHCl(HgCl2/活性炭作催化剂)。某学习小组的同学用下列装置测定该反应中乙炔的转化率(不考虑其他副反应)。铁架台及夹持仪器未画出。(已知![]() 的熔点为-159.8℃,沸点为-134℃。乙炔、氯乙烯、氯化氢均不溶于液体A)
的熔点为-159.8℃,沸点为-134℃。乙炔、氯乙烯、氯化氢均不溶于液体A)
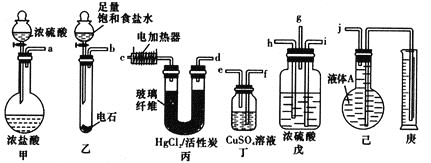
(1)各装置的连接顺序为(箭头方向即为气流方向):_________→________→_________→h→_________→______→_________→__________
(2)戊装置除了均匀混合气体之外,还有_________和_________的作用。
(3)乙装置中发生反应的化学方程式为_________________________________。
(4)若实验所用的电石中含有1.28gCaC2,甲装置中产生0.02mol的HCl气体。则所选用的量筒的容积较合理的是_______![]() 填字母代号
填字母代号![]() 。
。
A.500ml B.1000ml C.2000ml
(5)假定在标准状况下测得庚中收集到的液体A的体积为672ml(导管内气体体积忽略不计),则乙炔的转化率为_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】由一氧化碳、甲烷和乙烷组成的混合气体8.96L(标准状况),在足量氧气中充分燃烧后,生成气体先通过足量浓硫酸、再通过足量氢氧化钠溶液,测知氢氧化钠溶液增重26.4g,则原混合气体中乙烷的物质的量为
A. 0.1mol B. 0.2mol
C. 大于或等于0.2mo1,小于0.3mol D. 大于0.1mol,小于0.3mol
查看答案和解析>>
科目: 来源: 题型:
【题目】以氮化镓(GaN)、砷化镓(GaAs)为代表的第三代半导体材料目前已成为全球半导体研究的前沿和热点,如砷化镓灯泡寿命是普通灯泡的100倍,而耗能仅为10%,推广砷化镓等发光二极管(LED)照明,是节能减排的有效举措。请回答下列问题:
(1)镓为元素周期表第31号元素,基态镓原子的电子排布式为___________,核外电子占据最高能层符号为________。
(2)氮化镓与金刚石具有相似的晶体结构,氮化镓中氮原子与镓原子之间以_______键相结合,氮化镓属于_______晶体。
(3)下列说法正确的是_______
A.第一电离能:As < Ga B.砷和镓都属于p区元素
C.电负性:As < Ga D.半导体GaP、SiC与砷化镓为等电子体
(4)①砷化镓是将(CH3)3Ga和AsH3用MOCVD(金属有机物化学气相淀积)方法制备得到的,该反应在700℃进行,反应的方程式为:____________________。
②反应物AsH3分子的几何构型为_______,(CH3)3Ga中镓原子杂化方式为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】第四周期中的18种元素具有重要的用途,在现代工业中备受青睐。
(1)钛原子的价电子排布式为______________________,TiCl4沸点136℃,熔点-25℃,晶体类型为___________晶体。
(2)铜的第二电离能(I2)却大于锌的第二电离能,其主要原因是______________________。
(3)与As同主族的短周期元素是N、P。AsH3中心原子轨道杂化的类型_________________;一定压强下将AsH3、NH3和PH3的混合气体降温时液化顺序是______________________,理由是______________________。
(4)铬是一种硬而脆抗腐蚀性强的金属,常用于电镀和制造特种钢。下图1为铬的晶胞结构图,则铬晶胞属于___________堆积;该晶胞中原子的体积占晶胞体积的百分率为___________。

(5)钴晶体的一种晶胞(如图2所示)的边长为anm,密度为ρg·cm-3,NA表示阿伏加德罗常数的值,则钴原子半径为___________mm,钴的相对原子质量可表示为___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述或书写正确的是
A.![]()
![]() ,则相同条件下,
,则相同条件下,![]() 气体的能量大于1mol氢气和1mol氟气的能量之和
气体的能量大于1mol氢气和1mol氟气的能量之和
B.![]()
![]() ,则反应物的总键能小于生成物的总键能
,则反应物的总键能小于生成物的总键能
C.含![]() 的稀溶液与稀盐酸完全中和,放出
的稀溶液与稀盐酸完全中和,放出![]() 的热量,则表示该中和反应的热化学方程式为
的热量,则表示该中和反应的热化学方程式为![]()
![]()
D.![]() 、30MPa时,发生反应
、30MPa时,发生反应![]()
![]()
![]() 在此条件下将
在此条件下将![]() 和过量
和过量![]() 充分反应,放出热量
充分反应,放出热量![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】以硅藻土为载体的五氧化二钒![]() 是接触法生成硫酸的催化剂。从废钒催化剂中回收
是接触法生成硫酸的催化剂。从废钒催化剂中回收![]() 既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
物质 |
|
|
|
|
|
|
质量分数 |
|
|
|
|
|
|
如图1是一种废钒催化剂回收工艺路线:
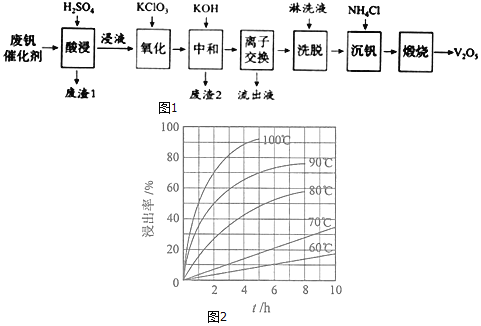
回答下列问题:
(1)“酸浸”时![]() 转化为
转化为![]() ,反应的离子方程式为______,同时
,反应的离子方程式为______,同时![]() 转成
转成![]() 为提高浸出速率,除适当增加硫酸浓度浓度外,还可采取的措施有______
为提高浸出速率,除适当增加硫酸浓度浓度外,还可采取的措施有______![]() 写出两条
写出两条![]() 。“废渣1”的主要成分是______。
。“废渣1”的主要成分是______。
(2)“酸浸”实验中,钒的浸出率结果如图2所示。由图可知,当钒的浸出率为![]() 时,所采用的实验条件为______。
时,所采用的实验条件为______。
(3)“氧化”中欲使3mol的![]() 变为
变为![]() ,则需要氧化剂
,则需要氧化剂![]() 至少为______mol。
至少为______mol。
(4)“中和”作用之一是使钒以![]() 形式存在于溶液中。“废渣2”中含有______。
形式存在于溶液中。“废渣2”中含有______。
(5)“离子交换”和“洗脱”可简单表示为:![]()
![]()
![]() 为强碱性阴离子交换树脂
为强碱性阴离子交换树脂![]() 。为了提高洗脱效率,淋洗液应该呈______性
。为了提高洗脱效率,淋洗液应该呈______性![]() 填“酸”、“碱”或“中”
填“酸”、“碱”或“中”![]() 。
。
(6)“流出液”中阳离子最多的是______。
(7)“沉钒”得到偏钒酸铵![]() 沉淀,写出“煅烧”中发生反应的化学方程式______。
沉淀,写出“煅烧”中发生反应的化学方程式______。
查看答案和解析>>
科目: 来源: 题型:
【题目】2018年8月31日,华为公司发布AI芯片麒麟980,标志着我国高科技企业的芯片制造技术迈入国际领先水平。组成芯片的核心物质是高纯度硅。下图是以石英砂为原料同时制备硅和金属锂的流程。![]() 石英砂的主要成分为
石英砂的主要成分为![]() ,含有少量
,含有少量![]() 、
、![]() 、
、![]()
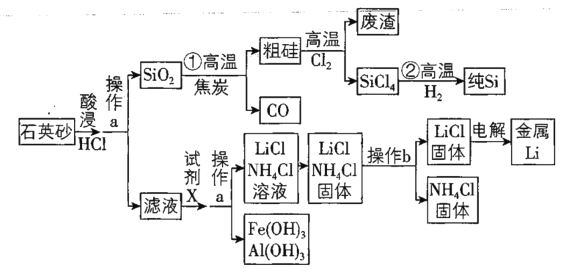
已知:LiCl的熔点是![]() 、沸点是
、沸点是![]() ;
;![]() 在
在![]() 分解完全。常温下,
分解完全。常温下,![]() ,
,![]() 。
。
(1)粗硅中常含有副产物SiC,请写出![]() 中生成SiC的反应方程式__________。
中生成SiC的反应方程式__________。
(2)操作a为___________;试剂X是___________。
(3)已知操作b为加热,可选择的适宜温度是______
![]()
![]()
![]()
![]()
(4)本生产工艺要求,要控制LiCl和![]() 溶液中的杂质离子浓度在
溶液中的杂质离子浓度在![]() 以下,应控制溶液的pH为_____,此时溶液中
以下,应控制溶液的pH为_____,此时溶液中![]() 的浓度为___________ 。
的浓度为___________ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】以玉米(主要成分是淀粉)为原料制备乙醇的流程如下:

下列说法中不正确的是
A. C12H22O11属于二糖
B. 1mol葡萄糖分解成3mol乙醇
C. 可用碘水检验淀粉是否完全水解
D. 可采取蒸馏的方法初步分离乙醇和水
查看答案和解析>>
科目: 来源: 题型:
【题目】绿色化学对化学反应提出了“原子经济性”(原子节约) 新概念及要求。理想的原子经济性反应是原料分子中的原子全部转变成所需产物,不产生副产物,实现零排放。下列反应符合“原子经济性”要求的是( )
A.乙醇与氧气在银的催化作用下反应制备乙醛
B.乙烷与氯气反应制备氯乙烷
C.以苯和乙烯为原料,在一定条件下反应生产乙苯
D.乙醇与浓硫酸共热制备乙烯
查看答案和解析>>
科目: 来源: 题型:
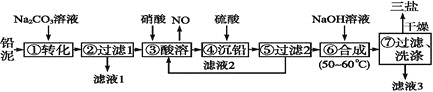
【题目】三盐![]() 可用作聚氯乙烯的热稳定剂,
可用作聚氯乙烯的热稳定剂,![]() 以上开始失去结晶水,不溶于水及有机溶剂。以铅泥
以上开始失去结晶水,不溶于水及有机溶剂。以铅泥![]() 主要成分为PbO、Pb及
主要成分为PbO、Pb及![]() 等
等![]() 为原料制备三盐的工艺流程如图所示。
为原料制备三盐的工艺流程如图所示。
已知:![]() 和
和![]() 的溶解度和溶度积Ksp如下表。
的溶解度和溶度积Ksp如下表。
化合物 |
|
|
溶解度 |
|
|
Ksp |
|
|
(1)步骤![]() 转化的目的是___ ,滤液1中的溶质为
转化的目的是___ ,滤液1中的溶质为![]() 和____
和____![]() 填化学式
填化学式![]() 。
。
(2)步骤![]() 酸溶时,为提高酸溶速率,可采取的措施是____
酸溶时,为提高酸溶速率,可采取的措施是____![]() 任写一条
任写一条![]() 。其中铅与硝酸反应生成
。其中铅与硝酸反应生成![]() 和NO的离子方程式为_______。
和NO的离子方程式为_______。
(3)滤液2中可循环利用的溶质的化学式为____。若步骤![]() 沉铅后的滤液中
沉铅后的滤液中![]() ,则此时
,则此时![]() _____
_____![]() 。
。
(4)步骤![]() 合成三盐的化学方程式为__________________。
合成三盐的化学方程式为__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com