
科目: 来源: 题型:
【题目】已知:草酸是一种弱酸,草酸晶体(H2C2O4·2H2O)易溶于水,熔点较低,加热会熔化、气化和分解。草酸(H2C2O4)与氢氧化钙的反应:H2C2O4+Ca(OH)2=CaC2O4↓(白色)+2H2O。
I.某小组同学配置0.1mol·L-1的草酸溶液480ml并验证草酸的性质
(1)配置该溶液需要草酸晶体___g。(已知H2C2O4·2H2O的相对分子质量为126)
(2)下列操作会使配置溶液的物质的量浓度偏低的是(________)
A.定容时俯视容量瓶刻度线
B.加水时超过刻度线,用胶头滴管吸出
C.转移过程中有少量的溶液溅出
D.称量固体时,砝码放在左盘
E.容量瓶用蒸馏水洗涤干净后没有干燥就移入所配置溶液
F.配置过程中,未用蒸馏水洗涤烧杯和玻璃棒
(3)取一定量草酸溶液装入试管,加入一定体积的酸性高锰酸钾溶液,振荡试管,发现溶液褪色(MnO4-被还原为Mn2+),反应的离子方程式为___;该反应的反应速率先慢后快的主要原因可能是___。
II.根据草酸晶体的组成,猜想其受热分解产物为CO、CO2和H2O。通过如图装置验证草酸晶体的部分分解产物。
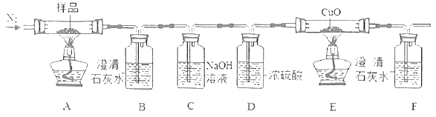
(4)反应开始前通入氮气的目的是___。
(5)B中澄清石灰水变浑浊,并不能证明产物中一定有CO2,理由是___。
(6)E中固体变成红色,F中澄清石灰水变浑浊,说明产物中含有气体___ (填化学式)。
(7)最后可用装置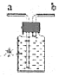 收集多余的CO,气体应从___端进入(选填“a”或“b”)。
收集多余的CO,气体应从___端进入(选填“a”或“b”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列热化学方程式或离子方程式中,正确的是( )
A.甲烷的标准燃烧热为-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g) + 2O2(g) = CO2(g) + 2H2O(g) ΔH = -890.3 kJ·mol-1
B.500C、30MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g) + 3H2(g)![]() 2NH3(g) ΔH = -38.6 kJ·mol-1
2NH3(g) ΔH = -38.6 kJ·mol-1
C.向明矾溶液中加入过量的氢氧化钡溶液:Al3+ + 2SO42-+ 2Ba2+ + 4OH- = 2BaSO4↓+ 2H2O + AlO2-
D.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4- + 5H2O2 + 6H+ = 2Mn2+ + 5 O2↑+8H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】盐酸氨溴索(又称溴环己胺醇),可用于急、慢性支气管炎及支气管扩张、肺气肿、肺结核等疾病的治疗。某研究小组拟用以下流程合成盐酸氨溴索和糖精的中间体X(部分反应条件及产物已略)。

已知信息:
(Ⅰ)R1CHO+R2NH2![]() R1CH=N﹣R2
R1CH=N﹣R2
(Ⅱ)![]()
![]()
![]() (易被氧化)
(易被氧化)
请回答:
(1)流程中A名称为_____;D中含氧官能团的名称是_____。
(2)G的分子式为_____;化合物E的结构简式是_____。
(3)A→B、F→G的反应类型分别为:_____、_____。
(4)写出B+C![]() D 的化学方程式_____。
D 的化学方程式_____。
(5)化合物X同时符合下列条件的同分异构体H有_____种;其中核磁共振氢谱有5组吸收峰的结构简式为_____。
①苯环上有两个取代基,其中之一是氨基;②官能团与X相同,苯环上的一氯代物有两种。
(6)以甲苯和甲醇为有机原料,参照盐酸氨溴索的合成路线图,设计X的合成路线______(无机试剂任选,标明试剂、条件及对应物质结构简式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验测得BH3为平面三角形(键角均为120°),NH3为三角锥型(键角为107.3°),已知电子数相同的微粒具有相似的结构。由此推断:①甲基,②甲基碳正离子(![]() ),③甲基碳负离子(
),③甲基碳负离子(![]() )的键角相对大小顺序为( )
)的键角相对大小顺序为( )
A.②>①>③B.①>②>③
C.③>①>②D.①=②=③
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组用下图装置制取并探究氯气的性质。[A装置中发生反应的化学方程式:2KMnO4+16HCl(浓) == 2KCl+2MnCl2 + 5Cl2↑+ 8H2O ]

【实验探究】
(1)A装置中a仪器的名称是_____________。
(2)制取氯气反应中KMnO4所起的作用是_____(填“氧化剂”或“还原剂”)。
(3)实验进行一段时间后,可观察到______(填“B”或“C”)装置中有色布条褪色,其褪色原因是______________________________________。
(4)当氯气进入D装置后,可观察到溶液颜色变为_______(填“红色”或“蓝色”),写出相关反应的化学方程式___________________________________。
(5)E装置中NaOH溶液的作用是_____________________________________。
(6)用31.6 g KMnO4固体与足量的浓盐酸反应,最多可生成标准状况下_____L氯气。(KMnO4的摩尔质量为158 g·mol—1)
【知识拓展】
(7)近年来,某些含氯的化合物(如ClO2、NaClO等)在生产、生活中应用广泛。
①高效净水剂ClO2中氯元素的化合价为_____________。
②NaClO是一种强氧化剂。某种家用洗涤剂含有NaClO,请写出NaClO在洗涤过程中的一种作用___________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是以苯酚为主要原料制取冬青油和阿司匹林的过程:
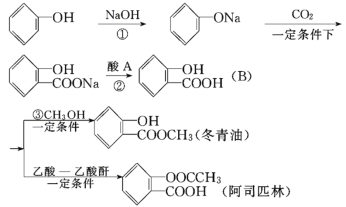
(1) 冬青油含有的官能团名称为________________
(2)B溶于冬青油致使产品不纯,加入下列哪种试剂后再分液即可除去_____
(A) NaOH 溶液 (B) Na2CO3溶液 (C) NaHCO3溶液 (D) Na
(3)写出第①步反应的化学方程式_________________________________.
(4)写出反应③的化学方程式_____________________________________
(5)1 mol 阿司匹林最多可与________ mol 氢氧化钠发生反应.
(6)化合物M是冬青油的同分异构体,与冬青油具有相同的官能团,能与氯化铁发生显色反应,苯环上有两个对位的取代基,写出两种M可能的结构简式____________
查看答案和解析>>
科目: 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)是重要的化工原料。具有较强的还原性,可用于棉织物漂白后的脱氯剂,定量分析中的还原剂。易溶于水,不溶于乙醇。Na2S2O35H2O于40~45℃熔化,48℃分解。实验室中常用亚硫酸钠和硫磺制备Na2S2O35H2O。制备原理为:Na2SO3+S+5H2O═Na2S2O35H2O。某化学兴趣小组在实验室制备硫代硫酸钠晶体并探究其化学性质。
Ⅰ.实验室制取Na2S2O35H2O晶体的步骤如下:
①称取12.6 g Na2SO3于烧杯中,溶于80.0 mL水。
②另取4.0 g硫粉,用少许乙醇润湿后,加到上述溶液中。
③水浴加热(如图1所示,部分装置略去),微沸,反应约1小时后过滤。
④滤液在经过蒸发浓缩、冷却结晶后析出Na2S2O35H2O晶体。
⑤进行减压过滤(如图2所示)、乙醇洗涤并干燥。请回答:
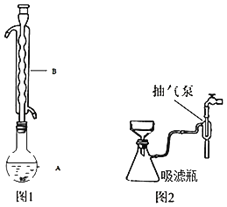
(1)仪器B的名称是_____。
(2)步骤④在浓缩过程中不能蒸发过度,其原因是_____。步骤⑤如欲停止抽滤,应先将吸滤瓶支管上的橡皮管拔下,再关抽气泵,其原因是_____。
(3)洗涤时为尽可能避免产品损失应选用的试剂是_____。
A.水 B.乙醇 C.氢氧化钠溶液 D.稀盐酸
Ⅱ.设计以下实验流程探究Na2S2O3的某些化学性质
![]()
(4)实验①Na2S2O3溶液pH=8的原因是_____(用离子方程式表示)。
(5)写出实验②中发生的离子反应方程式_____。
Ⅲ.用Na2S2O3的溶液测定溶液中ClO2的物质的量浓度,可进行以下实验。
步骤1:准确量取ClO2溶液10.00mL,稀释成100mL试样。
步骤2:量取V1 ML试样加入到锥形瓶中,调节试样的pH≤2.0,加入足量的KI晶体,摇匀,在暗处静置30分钟(已知:ClO2+I﹣+H+—I2+Cl﹣+H2O 未配平)。
步骤3:以淀粉溶液作指示剂,用c mol/L Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL(已知:I2+2S2O32﹣=2I﹣+S4O62﹣)。
(6)滴定终点现象是_____。根据上述步骤计算出原ClO2溶液的物质的量浓度为_____ mol/L(用含字母的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】一种新药物结构如图所示,下列有关该化合物说法正确的是
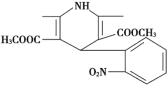
A.分子式为C17H17N2O6
B.能发生水解反应、聚合反应、取代反应、消去反应
C.分子中含有四种不同的官能团
D.能与氢气发生加成反应,但不能与溴的四氯化碳溶液反应
查看答案和解析>>
科目: 来源: 题型:
【题目】下列属于氧化还原反应的是( )
A.MgCl2 + Ba(OH)2 == BaCl2 + Mg(OH)2↓B.CO2 + 2NaOH == Na2CO3 + H2O
C.CaCO3 ![]() CaO + CO2↑D.H2 + CuO ==H2O + Cu
CaO + CO2↑D.H2 + CuO ==H2O + Cu
查看答案和解析>>
科目: 来源: 题型:
【题目】氮族元素及其化合物应用广泛。如合成氨、磷肥等化学肥料促进了粮食产量的极大提高。
(1)在基态31P原子中,核外存在_____对自旋相反的电子,核外电子占据的最高能级的电子云轮廓图为_____形。与31P同周期且相邻的元素的第一电离能由大到小的顺序为_____。
(2)液氨中存在电离平衡2NH3![]() NH4++NH2﹣,体系中三种微粒中N原子的杂化方式为_____,NH2﹣的立体构型为_____,与NH4+互为等电子体的分子为_____。
NH4++NH2﹣,体系中三种微粒中N原子的杂化方式为_____,NH2﹣的立体构型为_____,与NH4+互为等电子体的分子为_____。
(3)苯胺 ![]() 与甲苯
与甲苯 ![]() 的相对分子质量相近,但苯胺的熔点(﹣5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(﹣95℃)、沸点(110.6℃),原因是_____。
的相对分子质量相近,但苯胺的熔点(﹣5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(﹣95℃)、沸点(110.6℃),原因是_____。
(4)我国科学工作者实现世界首次全氮阴离子(N5﹣)金属盐Co(N5)2(H2O)44H2O的合成,其结构如图所示,Co2+的配位数为_____;N5﹣的化学键类型为_____。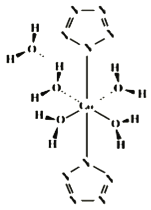
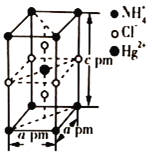
(5)把特定物质的量之比的NH4Cl和HgCl2在密封管中一起加热时,生成晶体X,其晶胞的结构图及晶胞参数如图所示。则晶体X的密度为_____ g/cm3(设阿伏加德罗常数的值为NA,列出计算式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com