
科目: 来源: 题型:
【题目】某恒定温度下,在一个2L的密闭容器中,加入4 mol A和2 mol B进行如下反应:3A (g)+2B (g)4C (?)+2D (?),“?”代表状态不确定。反应一段时间后达到平衡,测得生成 1.6 mol C,且反应前后压强之比为5:4,则下列说法正确的是
A.增加C,B的平衡转化率不变
B.此时B的平衡转化率是35%
C.增大该体系的压强,平衡向右移动,化学平衡常数增大
D.该反应的化学平衡常数表达式是K=![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】海水淡化是解决沿海城市饮用水问题的关键技术。下图是电渗析法淡化海水装置的工作原理示意图(电解槽内部的“┆”和“│”表示不同类型的离子交换膜)。工作过程中b电极上持续产生Cl2。下列关于该装置的说法错误的是
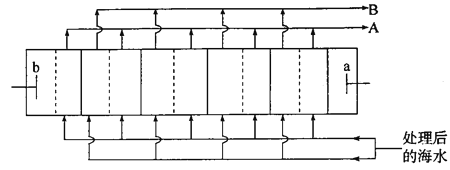
A. 工作过程中b极电势高于a极
B. “┆”表示阴离子交换膜,“│”表示阳离子交换膜
C. 海水预处理主要是除去Ca2+、Mg2+等
D. A口流出的是“浓水”,B口流出的是淡水
查看答案和解析>>
科目: 来源: 题型:
【题目】下列事实不能用勒夏特列原理(平衡移动原理)解释的是
①溴水中存在化学平衡:Br2+H2O ![]() HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅
HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅
②铁在潮湿的空气中易生锈
③二氧化氮与四氧化二氮的平衡体系,增大压强后颜色加深
④合成氨反应,为提高氨的产率,理论上应采取降低温度的措施
⑤钠与氯化钾共融制备钾:Na(l)+KCl(l) ![]() K(g)+NaCl(l)
K(g)+NaCl(l)
⑥反应CO(g)+NO2(g) ![]() CO2(g)+NO(g)(正反应为放热反应),达到化学平衡后,升高温度体系的颜色加深
CO2(g)+NO(g)(正反应为放热反应),达到化学平衡后,升高温度体系的颜色加深
A. ①④ B. ②③ C. ②⑥ D. ②③⑥
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是元素周期表的一部分,表中所列的字母分别代表一种元素。
A | |||||||||||||||||
B | C | D | E | F | T | ||||||||||||
G | H | I | J | K | L | ||||||||||||
M | N | O | |||||||||||||||
试回答下列问题(注意:每问中的字母代号为上表中的字母代号,并非为元素符号)
(1)N的单质和水蒸气反应能生成固体X,则I的单质与X反应的化学方程式_______。
(2)D的气态氢化物的VSEPR模型的名称为_______。
(3)由A、C、D形成的ACD分子中,σ键和π键个数比= _______________。
(4)要证明太阳上是否含有R 元素,可采用的方法是__________________________。
(5)元素M的化合物(ME2L2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。回答问题:
①ME2L2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断ME2L2是_________(填“极性”或“非极性”)分子。
②将N和O的单质用导线连接后插入D的最高价氧化物对应的水化物浓溶液中,可制成原电池,则组成负极材料的元素的外围电子轨道表示式为______________________。
(6)往O2+溶液中加入氨水,形成蓝色沉淀,继续加入氨水,难溶物溶解变成蓝色透明溶液,写出沉淀溶解的离子方程式_____。
(7)若F 、K两种元素形成的化合物中中心原子的价电子全部参与成键,则该化合物的空间构型的名称为___。
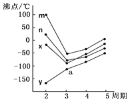
(8)如图四条折线分别表示ⅣA族、ⅤA族、ⅥA族、ⅦA族元素气态氢化物沸点变化,则E的氢化物所在的折线是__(填m、n、x或y)。
(9)1183 K以下纯N晶体的基本结构单元如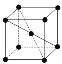 所示,1183 K以上转变为
所示,1183 K以上转变为 所示结构的基本结构单元。在1183 K以下的晶体中,空间利用率为____;在1183 K以上的晶体中,与N原子等距离且最近的N原子数为____,晶体堆积方式的名称为_____。
所示结构的基本结构单元。在1183 K以下的晶体中,空间利用率为____;在1183 K以上的晶体中,与N原子等距离且最近的N原子数为____,晶体堆积方式的名称为_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】在元素周期表中,除稀有气体外几乎所有元素都能与氢形成氢化物。
(1)氨气属于共价型氢化物,工业常用氨气和醋酸二氨合铜[Cu(NH3)2]Ac的混合液来吸收CO(醋酸根离子简写为Ac-)。反应方程式为:[Cu(NH3)2]Ac+CO+NH3=[Cu(NH3)3CO]Ac
①氨水溶液中各元素原子的第一电离能从大到小排列顺序为___________。
②醋酸分子(CH3COOH)中的两个碳原子的杂化方式分别是_________________。
③生成物[Cu(NH3)3CO]Ac中所含化学键类型有_________(填序号)。
A.离子键b.金属键c.共价键d.配位键
(2)某离子化合物XY2,晶胞结构如图所示,其中6个Y原子用数字1~6标注。
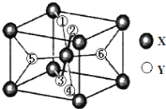
已知1、2、3、4号Y原子在晶胞上、下面上,则5、6号Y原子均在晶胞_________(填“侧面”或“内部”)。
②根据以上信息可以推知,XY2晶体的熔沸点______(填“>”、“=”或“<”)固态氨的熔沸点。
③若该晶胞的边长为anm,密度为ρg/cm3,XY2的摩尔质量为Mg/mol,则阿伏加德罗常数为____。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于各图的叙述正确的是( )
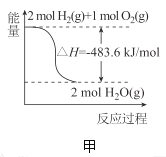
A.甲表示![]() 与
与![]() 发生反应过程中的能量变化,则
发生反应过程中的能量变化,则![]() 的燃烧热为
的燃烧热为![]()
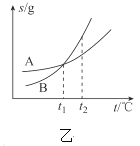
B.乙表示A、B两物质的溶解度随温度变化情况,将![]() 时A、B的饱和溶液分别升温至
时A、B的饱和溶液分别升温至![]() 时,溶质的质量分数
时,溶质的质量分数![]()
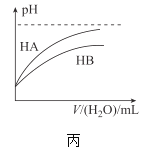
C.丙表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则相同浓度的NaA溶液的pH小于同浓度NaB溶液的pH
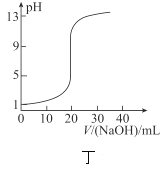
D.丁表示![]() 溶液滴定
溶液滴定![]() 醋酸溶液得到的滴定曲线
醋酸溶液得到的滴定曲线
查看答案和解析>>
科目: 来源: 题型:
【题目】金晶体的晶胞为面心立方堆积,如图所示。设金原子的直径为d,用NA表示阿伏加德罗常数,在立方体的各个面的对角线上,3个金原子彼此两两相切,M表示金的摩尔质量。则下列说法错误的是( )

A.金晶体每个晶胞中含有4个金原子
B.金属键无方向性,金属原子尽可能采取密堆积
C.一个晶胞的体积是16![]() d3
d3
D.金晶体的密度是![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】有四种常见药物:①阿司匹林、②青霉素、③胃舒平、④麻黄碱。请回答下列问题。.
(1)由于具有兴奋作用,国际奥委会严禁运动员服用的药物是_______(填序号)。
(2)滥用_______(填序号)药物会导致不良后果,若过量服用会引起中毒,应立即停药,并静脉注射![]() 溶液。
溶液。
(3)某同学胃酸过多,应选用的药物是______(填序号);抗酸药是治疗胃酸过多的一类药物,写出一种抗酸药中和胃酸的化学方程式________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,向下列溶液中通入相应的气体至溶液pH=7(通入气体对溶液体积的影响可忽略),溶液中部分微粒的物质的量浓度关系正确的是( )
A. 向0.10mol·L-1NH4HCO3溶液中通入CO2:c(NH4+)=c(HCO3-)+c(CO32-)
B. 向0.10mol·L-1NaHSO3溶液中通入NH3:c(Na+)>c(NH4+)>c(SO32-)
C. 0.10mol·L-1Na2SO3溶液通入SO2:c(Na+)=2[c(SO32-)+c(HSO3-)+c(H2SO3)]
D. 0.10mol·L-1CH3COONa溶液中通入HCl:c(Na+)>c(CH3COOH)=c(Cl-)
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,向某密闭容器中加入一定量的N2和H2发生可逆反应:N2(g)+3H2(g) ![]() 2NH3(g) ΔH = -92.2kJmol—1,测得0到10秒内,c(H2)减小了0.75molL—1,下列说法正确的是
2NH3(g) ΔH = -92.2kJmol—1,测得0到10秒内,c(H2)减小了0.75molL—1,下列说法正确的是
A.10到15秒内c(NH3) 增加量等于0.25mol L—1
B.化学反应速率关系是:3υ正(H2)= 2υ正(NH3)
C.达平衡后,分离出少量NH3,V正 增大
D.该反应的逆反应的活化能不小于92.2kJmol—1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com