
科目: 来源: 题型:
【题目】设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
A.12g NaHSO4晶体中阳离子和阴离子的总数为0.3NA
B.密闭容器中2 mol NO与1mol O2充分反应,产物的分子数目为2NA
C.在一定条件下,6.4g铜与过量的硫反应,转移的电子数目为0.2NA
D.10g质量分数为46%的乙醇溶液中O-H键数目为0.7NA
查看答案和解析>>
科目: 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A.标准状况下,33.6LHF中含有氟原子的数目为1.5NA
B.2.8gCO与C2H4的混合气体中所含分子数为0.1NA
C.50 mL 18.4 mol·L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA
D.含1molFeCl3的氯化铁溶液完全水解生成Fe(OH)3胶体,其中胶粒数为NA
查看答案和解析>>
科目: 来源: 题型:
【题目】关于下列各图的叙述,正确的是( )

A.甲表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为483.6Kjmol﹣1
B.乙表示恒温恒容条件下发生的可逆反应2NO2![]() N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
C.丙表示A、B两物质的溶解度随温度变化情况,将A、B饱和溶液分别由t1℃升温至t2℃时,溶质的质量分数B>A
D.丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则同浓度的NaA溶液的pH小于NaB溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】关于一些重要的化学概念有下列说法,其中正确的是( )
①Fe(OH)3胶体和CuSO4溶液都是混合物 ②BaSO4是一种难溶于水的强电解质 ③冰醋酸、纯碱、小苏打分别属于酸、碱、盐 ④煤的干馏、煤的气化和液化都属于化学变化 ⑤置换反应都属于离子反应
A.①②⑤B.①②④C.②③④D.③④⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】以煤为原料可合成一系列燃料。
(1)已知:①2H2(g)+O2(g)= 2H2O(g)△H=-483.6kJ/mol
②CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H=+49.0kJ/mol
请写出甲醇燃烧生成H2O(g)的热化学方程式_________;
(2)向1L密闭容器中加入2mol CO、4mol H2,在适当的催化剂作用下,发生反应:2CO(g)+4H2(g)![]() CH3OCH3(l)+H2O(l)△H=+71kJ/mol
CH3OCH3(l)+H2O(l)△H=+71kJ/mol
①该反应能否_________自发进行(填“能”、“不能”或“无法判断”)
②下列叙述能说明此反应达到平衡状态的是_________.
a.混合气体的平均相对分子质量保持不变
b.CO和H2的转化率相等
c.CO和H2的体积分数保持不变
d.混合气体的密度保持不变
e.1mol CO生成的同时有1mol O-H键断裂
(3)CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H<0在一定条件下,某反应过程中部分数据如下表:
CH3OH(g)+H2O(g)△H<0在一定条件下,某反应过程中部分数据如下表:
反应条件 | 反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) |
恒温 恒容 (T1℃、 2L) | 0min | 2 | 6 | 0 | 0 |
10min | 4.5 | ||||
20min | 1 | ||||
30min | 1 |
①0~10min内,用H2O(g)表示的化学反应速率v(H20)=_________mol/(L·min)
②达到平衡时,该反应的平衡常数K=_________(用分数表示),平衡时H2的转化率是_________。
③在其它条件不变的情况下,若30min时改变温度为T
(4)用甲醚(CH3OCH3)作为燃料电池的原料,请写出在碱性介质中电池负极反应式_________.
查看答案和解析>>
科目: 来源: 题型:
【题目】有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 和
和![]() 六种粒子,属于同一氧化还原反应中的反应物和生成物,下列叙述不正确的是
六种粒子,属于同一氧化还原反应中的反应物和生成物,下列叙述不正确的是
A.被氧化和被还原的离子数目比为![]()
B.该反应说明![]() 、
、![]() 、、
、、![]() 在溶液不能大量共存
在溶液不能大量共存
C.每![]() 发生氧化反应,转移
发生氧化反应,转移![]()
D.若利用该反应设计原电池,则负极反应为:![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】元素![]() 、
、![]() 、
、![]() 在周期表中的相对位置如图所示。已知
在周期表中的相对位置如图所示。已知![]() 元素原子的外围电子排布式为
元素原子的外围电子排布式为![]() ,则下列说法不正确的是( )
,则下列说法不正确的是( )
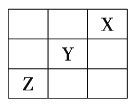
A.![]() 元素原子的价电子排布式为
元素原子的价电子排布式为![]()
B.![]() 元素在元素周期表的第三周期第ⅥA族
元素在元素周期表的第三周期第ⅥA族
C.![]() 元素所在周期中所含非金属元素最多
元素所在周期中所含非金属元素最多
D.![]() 元素原子的核外电子排布式为
元素原子的核外电子排布式为![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】市场上经常见到的标记为Li-ion的电池。它的负极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料。这种锂离子电池的电池反应式为: Li+2Li0.35NiO2![]() 2Li0.85NiO2,下列说法正确的是
2Li0.85NiO2,下列说法正确的是
A. 充电时,该电池的正极应外接电源负极
B. 充电时,Li0.85NiO2既发生氧化反应又发生还原反应
C. 该电池既能用酸溶液又能用碱溶液作电解质溶液。
D. 放电过程中Li+向负极移动
查看答案和解析>>
科目: 来源: 题型:
【题目】溶液中的化学反应大多是离子反应。根据要求回答下列问题:
(1)Na2CO3溶液显碱性的原因,用离子反应方程式表示_____________________________;CuSO4溶液呈酸性的原因,用离子反应方程式表示:___________________________。
(2)25 ℃时,pH为9的CH3COONa溶液中c(OH-)=________。
(3)25 ℃时,将a mol·L-1氨水与0.01 mol·L-1盐酸等体积混合,反应平衡时溶液中c(NH![]() )=c(Cl-),则溶液显________(填“酸”“碱”或“中”)性。用含a的代数式表示NH3·H2O的电离常数Kb=___________。
)=c(Cl-),则溶液显________(填“酸”“碱”或“中”)性。用含a的代数式表示NH3·H2O的电离常数Kb=___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】Mg-LiFePO4电池的电池反应为![]() ,其装置示意图如下:(锂离子导体膜只允许Li+通过)。下列说法正确的是
,其装置示意图如下:(锂离子导体膜只允许Li+通过)。下列说法正确的是

A.放电时,Li+被还原
B.放电时,电路中每流过2 mol电子,有1 mol Mg2+迁移至正极区
C.充电时,阳极上发生的电极反应为:![]()
D.充电时,导线上通过1 mol电子,左室溶液质量减轻12 g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com