
科目: 来源: 题型:
【题目】二氧化锰是制造锌锰干电池的基本材料,工业上以软锰矿、菱锰矿为原料来制备。某软锰矿主要成分为MnO2,还含有Si(16.27%),Fe(5.86%),Al(3.42%),Zn(2.68%)和Cu(0.86%)等元素的氧化物,其处理流程图如下:
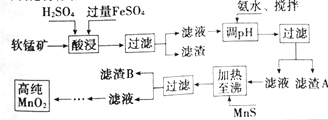
化合物 | Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
KSP近似值 | 10-34 | 10-16 | 10-38 |
(1)灼烧软锰矿样品时,铜的焰色为___(填字母)。
A.黄色 B.绿色 C.紫色 D.红色
(2)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要离子反应方程式为___。
(3)“氨水、搅拌”,其中“搅拌”不仅能加快反应速率,还能___。滤渣S的成分是Fe(OH)3、Al(OH)3,加入氨水需调节pH至少达到___,恰好能使Fe3+、Al3+沉淀完全(当c≤10-5mol·L-1时,认为该离子沉淀完全)。
(4)滤渣B的成分是___。
(5)工业上采用间接氧化还原滴定法测定MnO2纯度,其操作过程如下:准确称量0.9200g该样品,与足量酸性KI溶液充分反应后,配制成100mL溶液。取其中10.00mL,恰好与25.00mL0.0800 mol·L-1 Na2S2O3溶液反应(I2+2S2O32-=2I-+S4O62-)。计算该样品纯度为___%(精确到0.1%)。
(6)从废旧碱性锌锰电池中可以回收利用的物质有___(写两种)。
查看答案和解析>>
科目: 来源: 题型:
【题目】电化学原理在生产生活中应用十分广泛。请回答下列问题:
(1)通过SO2传感器可监测大气中SO2的含量,其工作原理如图1所示。
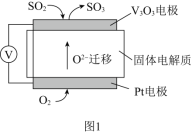
①固体电解质中O2-向______极移动(填“正”或“负”)。
②写出V2O5电极的电极反应式:_____________。
(2)近期科学家研究发现微生物可将生产废水中的尿素[CO(NH2)2]直接转化为对环境友好的两种物质,其工作原理如图2所示。回答下列问题:
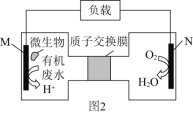
①N极为____极(填“正”或“负”),M电极反应式______________________。
②N极消耗标准状况下33.6L气体时,M极理论上处理的尿素的质量为______g。
(3)人工光合系统装置(如图)可实现以CO2和H2O合成CH4。下列说法不正确的是__________。
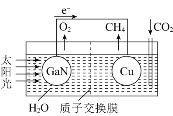
A.该装置为原电池,且铜为正极
B.电池工作时,H+向Cu电极移动
C.GaN电极表面的电极反应式为2H2O-4e-=O2+4H+
D.反应CO2+2H2O![]() CH4+2O2中每消耗1molCO2转移4mole-
CH4+2O2中每消耗1molCO2转移4mole-
查看答案和解析>>
科目: 来源: 题型:
【题目】可燃冰(天然气水合物,可用CH4xH2O表示)的开采和利用,既有助于解决人类面临的能源危机,又能生产一系列的工业产品。
(1)可燃冰在一定条件下能够释放出CH4气体,该条件是________(填“低温、高压”或“高温、低压”)。
(2)熔融碳酸盐型燃料电池(MCFC)通常被称为第二代燃料电池。以CH4为MCFC的燃料时,电池的工作原理如图所示。
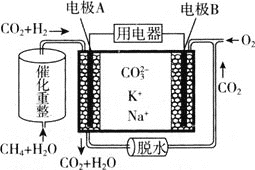
①CH4(g)和H2O(g)可在电池内部经重整反应转化为H2(g)和CO2(g),已知CH4和H2的标准燃烧热分别为890.3kJ/mol和285.8kJ/mol,H2O(l)=H2O(g) H=+41 kJ/mol,则甲烷重整反应的热化学方程式为CH4(g)+2H2O(g)=4H2(g)+CO2(g) H=________kJ/mol。
②图中电极A为燃料电池的________(填“正极”或“负极”),电极B上的电极反应式为________。
(3)在压强为p的恒压容器中,CH4在电弧炉的作用下制取乙炔,化学方程式为2CH4=C2H2+3H2。下表为反应体系的物料衡算表。
成分 | 进料 | 出料 | ||
纯CH4 | CH4 | C2H2 | H2 | |
物质的量(mol) | 44.8 | 19.13 | 8.96 | 39.5 |
①计算可知C2H2的产率α=________。
②出料中C2H2和H2的物质的量之比并不等于1:3,可能的原因是________。
查看答案和解析>>
科目: 来源: 题型:
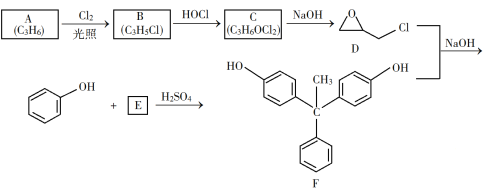
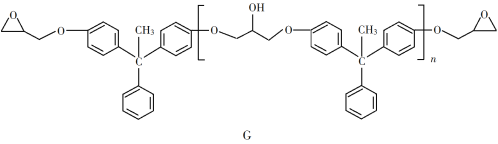
【题目】环氧树脂因其具有良好的机械性能、绝缘性能以及与各种材料的粘结性能,已广泛应用于涂料和胶黏剂等领域。下面是制备一种新型环氧树脂G的合成路线:
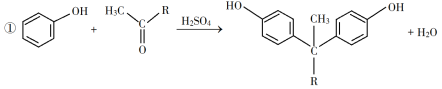
已知以下信息:
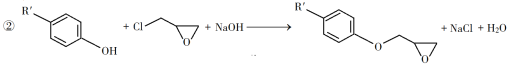
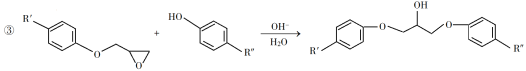
(1)A是一种烯烃,化学名称为__________。
(2)由B生成C的反应类型为__________。
(3)由C生成D的反应方程式为__________。
(4)E的结构简式为__________。
(5)E的二氯代物有多种同分异构体,请写出其中能同时满足以下条件的芳香化合物的结构简式_____、_______。
①能发生银镜反应;②核磁共振氢谱有三组峰,且峰面积比为3∶2∶1。
(6)假设化合物D、F和NaOH恰好完全反应生成1 mol单一聚合度的G,若生成的NaCl和H2O的总质量为765 g,则G的n值理论上应等于__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】过氧化钙是一种白色固体,微溶于冷水,不溶于乙醇,化学性质与过氧化钠类似。某学习小组设计在碱性环境中利用CaCl2与H2O2反应制取CaO2·8H2O,装置如图所示:
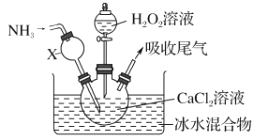
回答下列问题:
(1)小组同学查阅文献得知:该实验用质量分数为20%的H2O2溶液最为适宜。市售H2O2溶液的质量分数为30%。该小组同学用市售H2O2溶液配制约20%的H2O2溶液的过程中,使用的玻璃仪器除玻璃棒、胶头滴管外,还有_______________。
(2)仪器X的主要作用除导气外,还具有的作用是_________。
(3)在冰水浴中进行的原因是______________________。
(4)实验时,在三颈烧瓶中析出CaO2·8H2O晶体,总反应的离子方程式为__________。
(5)反应结束后,经过滤、洗涤、低温烘干获得CaO2·8H2O。下列试剂中,洗涤CaO2·8H2O的最佳选择是_______。
a.无水乙醇 b.浓盐酸 c.Na2SO3溶液 d.CaCl2溶液
(6)过氧化钙(与过氧化钠性质相似)可用于长途运输鱼苗,这体现了过氧化钙具有_____的性质。
a.与水缓慢反应供氧 b.能吸收鱼苗呼出的CO2气体 c.能使水体酸性增强
(7)将所得CaO2·8H2O晶体加热到150~160℃,完全脱水后得到过氧化钙样品。
该小组测定过氧化钙样品中CaO2的纯度的方法是:准确称取0.4000g过氧化钙样品,400℃以上加热至完全分解成CaO和O2(设杂质不产生气体),得到33.60mL(已换算为标准状况)气体。则所得过氧化钙样品中CaO2的纯度为________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
苯 | 溴 | 溴苯 | |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
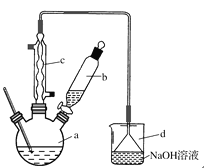
按下列合成步骤回答问题:
(1)在a中加入15 mL无水苯和少量铁屑。由b向a中加入4 mL液溴。烧瓶a中发生反应的化学方程式是______。装置d的作用是_________________;装置c的作用是__________________。
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10 mL水,然后过滤除去未反应的铁屑;
②滤液依次用10 mL水、8 mL 10%的NaOH溶液、10 mL水洗涤。NaOH溶液洗涤的作用是________________________;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是____________。
(3)经过上述分离操作后,粗溴苯中还含有的主要杂质的名称是________,进一步提纯操作方法是________。
(4)在该实验中,a的容积最适合的是________(填字母)。
A.25 mL B.50 mL C.250 mL D.500 mL
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A的产量通常用来衡量一个国家的石油化工发展水平,B、D是饮食中两种常见的有机物,F是一种有香味的物质,F中碳原子数是D的两倍。现以A为主要原料合成F和高分子化合物E,其合成路线如图所示。

(1)A的结构式为__________,B中决定其性质的重要官能团的名称为____________。
(2)写出反应的化学方程式并判断反应类型。
①____________________________________反应类型:__________。
②_____________________________________反应类型:__________。
(3)实验室怎样鉴别B和D?_________________________。
(4)在实验室里我们可以用如下图所示的装置来制取F,乙中所盛的试剂为_______,该溶液的主要作用是_____________________________________;
(5)该装置图中有一个明显的错误是_____________________________。

查看答案和解析>>
科目: 来源: 题型:
【题目】某烃A是有机化学工业的基本原料,还是一种植物生长调节剂,A可发生如图所示的一系列化学反应,其中①②③属于同种反应类型。根据图回答下列问题:

(1)写出A、B、C、D的结构简式:A___,B___,C__,D__。
(2)写出②④两步反应的化学方程式,并注明反应类型:
②___,反应类型:___。
④___,反应类型:___。
查看答案和解析>>
科目: 来源: 题型:
【题目】高分子材料在疫情防控和治疗中起到了重要的作用。下列说法正确的是
A.聚乙烯是生产隔离衣的主要材料,能使酸性高锰酸钾溶液褪色
B.聚丙烯酸树脂是3D打印护目镜镜框材料的成分之一,可以与NaOH溶液反应
C.天然橡胶是制作医用无菌橡胶手套的原料,它是异戊二烯发生缩聚反应的产物
D.聚乙二醇可用于制备治疗新冠病毒的药物,聚乙二醇的结构简式为![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)基态O原子核外电子排布式为_______,基态P原子核外占据最高能级的电子云轮廓图为_________形;
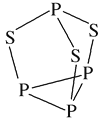
(2)P4S3可用于制造火柴,其分子结构如图所示。P4S3分子中硫原子的杂化轨道类型为___________,每个P4S3分子中含孤电子对的数目为_______。
(3)Na、O、S简单离子半径由大到小的顺序为__________
(4)SO2易溶于水,在水中的溶解度为1体积的水溶解40体积的SO2,原因是________。
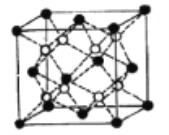
(5)Li2O的晶胞如图所示(其中白球代表Li,黑球代表O)。已知晶胞参数为0.4665 nm,阿伏加德罗常数的值为NA,则Li2O的密度为______g·cm3(列出计算式即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com