
科目: 来源: 题型:
【题目】亚硝酰氯![]() ,熔点:
,熔点:![]() ,沸点:
,沸点:![]() 为红褐色液体或黄色气体,具有刺鼻恶臭味,遇水剧烈水解生成氮的两种氧化物与氯化氢,易溶于浓硫酸。是有机物合成中的重要试剂,常可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。其制备装置如图所示
为红褐色液体或黄色气体,具有刺鼻恶臭味,遇水剧烈水解生成氮的两种氧化物与氯化氢,易溶于浓硫酸。是有机物合成中的重要试剂,常可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。其制备装置如图所示![]() 其中III、IV中均为浓硫酸
其中III、IV中均为浓硫酸![]() :
:
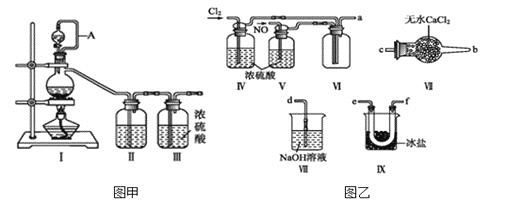
(1)用图甲中装置制备纯净干燥的原料气,补充下表中所缺少的药品。
| 装置Ⅰ | 装置Ⅱ | |
| 烧瓶中 | 分液漏斗中 | |
制备纯净 |
| 浓盐酸 |
|
制备纯净NO | Cu | 稀硝酸 |
|
(2)将制得的NO和![]() 通入图乙对应装置制备NOCl。
通入图乙对应装置制备NOCl。
![]() 装置连接顺序为
装置连接顺序为![]() ________
________![]() 按气流自左向右方向,用小写字母表示
按气流自左向右方向,用小写字母表示![]() 。
。
![]() 装置Ⅳ、Ⅴ除可进一步干燥NO、
装置Ⅳ、Ⅴ除可进一步干燥NO、![]() 外,还可以通过观察气泡的多少调节两种气体的流速。
外,还可以通过观察气泡的多少调节两种气体的流速。
![]() 有人认为可以将装置Ⅳ中浓硫酸合并到装置Ⅴ中,撤除装置Ⅳ,直接将NO、
有人认为可以将装置Ⅳ中浓硫酸合并到装置Ⅴ中,撤除装置Ⅳ,直接将NO、![]() 通入装置Ⅴ中,你同意此观点吗?_______
通入装置Ⅴ中,你同意此观点吗?_______![]() 填“同意”或“不同意”
填“同意”或“不同意”![]() ,原因是___________。
,原因是___________。
![]() 实验开始的时候,先通入氯气,再通入NO,原因为________________________。
实验开始的时候,先通入氯气,再通入NO,原因为________________________。
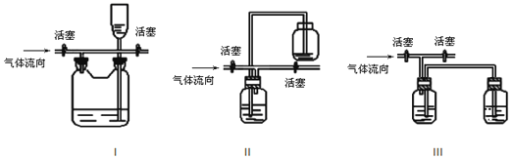
(3)有人认为多余的氯气可以通过下列装置暂时储存后再利用,请选择可以用作氯气的储气的装置 ______;
(4)装置Ⅶ吸收尾气时,NOCl发生反应的化学方程式为_______________________。
(5)有人认为装置Ⅶ中氢氧化钠溶液只能吸收氯气和NOCl,不能吸收NO,经过查阅资料发现用高锰酸钾溶液可以吸收NO气体,因此在装置Ⅶ氢氧化钠溶液中加入高锰酸钾,反应产生黑色沉淀,写出该反应的离子方程式:__________________________________。
(6)制得的NOCl中可能含有少量![]() 杂质,为测定产品纯度进行如下实验:称取
杂质,为测定产品纯度进行如下实验:称取![]() 样品溶于
样品溶于![]() 溶液中,加入几滴
溶液中,加入几滴![]() 溶液作指示剂,用足量硝酸酸化的
溶液作指示剂,用足量硝酸酸化的![]() 溶液滴定至产生砖红色沉淀,消耗
溶液滴定至产生砖红色沉淀,消耗![]() 溶液
溶液![]() 。则该样品的纯度为__________
。则该样品的纯度为__________![]() 保留1位小数
保留1位小数![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)写出用键线式表示的有机物的分子式![]() 分子式:______。
分子式:______。
(2)![]() 分子中最多有 ___________个原子共直线;最多有___________个原子共平面。
分子中最多有 ___________个原子共直线;最多有___________个原子共平面。
(3)烯烃A是2-丁烯的一种同分异构体,它在催化剂作用下与氢气反应的产物不是正丁烷,则A的结构简式为___________; A与溴的四氯化碳溶液反应的化学方程式为_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】硫代硫酸钠晶体![]() 又名大苏打、海波,主要用于照相业作定影剂、鞣革时作还原剂。易溶于水,遇酸易分解。实验室可用如下装置
又名大苏打、海波,主要用于照相业作定影剂、鞣革时作还原剂。易溶于水,遇酸易分解。实验室可用如下装置![]() 略去部分加持仪器
略去部分加持仪器![]() 模拟生成过程。
模拟生成过程。
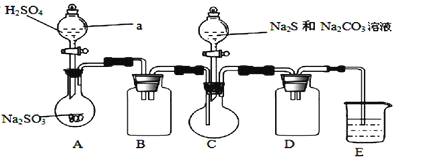
(1)实验室可利用![]() 晶体和质量分数为
晶体和质量分数为![]() 的硫酸制备
的硫酸制备![]() 气体,该反应中硫酸浓度不能太大的原因是_________________________。
气体,该反应中硫酸浓度不能太大的原因是_________________________。
(2)在C中制取硫代硫酸钠晶体时,先向C中烧瓶加入![]() 和
和![]() 混合溶液,再向A中烧瓶滴加
混合溶液,再向A中烧瓶滴加![]() 。则装置C中发生反应生成
。则装置C中发生反应生成![]() 的化学方程式为_________
的化学方程式为_________
(3)实验中,为使![]() 缓慢通入烧瓶C,采取的操作是_____________。装置D的作用是_______________。装置E中为__________溶液。
缓慢通入烧瓶C,采取的操作是_____________。装置D的作用是_______________。装置E中为__________溶液。
(4)继续通入![]() 气体至溶液PH接近7,停止通入气体,取下C,过滤。实验过程中若没及时停止通入气体,可能产生的后果是______________。反应终止后,烧瓶C中除析出
气体至溶液PH接近7,停止通入气体,取下C,过滤。实验过程中若没及时停止通入气体,可能产生的后果是______________。反应终止后,烧瓶C中除析出![]() ,其中可能含有
,其中可能含有![]() 杂质。为减少杂质
杂质。为减少杂质![]() 的量,第
的量,第![]() 步操作应稍作改动,具体操作是___________________
步操作应稍作改动,具体操作是___________________
(5)![]() 的溶解度随温度升高显著增大,所得粗产品通过_____________方法提纯。海波可用于摄影上的定影剂,因为它能与卤化银起化学反应,生成易溶于水的银络合物
的溶解度随温度升高显著增大,所得粗产品通过_____________方法提纯。海波可用于摄影上的定影剂,因为它能与卤化银起化学反应,生成易溶于水的银络合物![]() ,冲走胶片上多余的感光剂起定影作用,溴化银与海波反应的离子方程式为__________
,冲走胶片上多余的感光剂起定影作用,溴化银与海波反应的离子方程式为__________
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关说法正确的是
A.CaCO3(s) =CaO(s)+CO2(g) 在室温下不能自发进行,说明该反应![]() H<0
H<0
B.水的离子积常数Kw 随着温度的升高而增大,说明水的电离是放热反应
C.0.1mol·L-1Na2CO3溶液在50℃时的碱性比25℃强,说明盐类水解反应是放热反应
D.蒸发FeCl3溶液,所得固体在坩埚中充分加热,最后得到Fe2O3固体
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E都为短周期元素,A是相对原子质量最小的元素;B的+1价阳离子和C的﹣1价阴离子都与氖原子具有相同的电子层结构;D在C的下一周期,可与B形成BD型离子化合物;E和C为同一周期元素,其最高价氧化物对应的水化物为一种强酸。请根据以上信息回答下列问题:
(1)B元素在元素周期表中的位置是第______周期______族;
(2)画出C元素的原子结构示意图______;
(3)与E的氢化物分子所含电子总数相等的分子是______(举一例,填化学式,下同)、阳离子是______;
(4)A与D形成的化合物中含有化学键的类型是_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】某离子晶体晶胞的结构如图所示。X(●)位于立方体顶点,Y(○)位于立方体中心。试
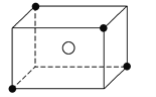
(1)晶体中每个Y同时吸引着__个X,每个X同时吸引着__个Y,该晶体的化学式为____________。
(2)晶体中每个X周围与它最接近且距离相等的X共有___个。
(3)晶体中距离最近的2个X与1个Y形成的夹角∠XYX是____。
(4)设该晶体的摩尔质量为Mg·mol-1,晶体密度为ρg·cm-3,阿伏加德罗常数的值为NA,则晶体中两个距离最近的X中心间距为___cm。
查看答案和解析>>
科目: 来源: 题型:
【题目】欲测定某NaOH溶液的物质的量浓度,可用0.1000mol·L-1HCl标准溶液进行中和滴定(用甲基橙作指示剂)。
请回答下列问题:
(1)滴定时,盛装待测NaOH溶液的仪器名称为 ,盛装标准盐酸的仪器名称为 ;滴定至终点的颜色变化为 。
(2)若甲学生在实验过程中,记录滴定前滴定管内液面读数为0.50mL,滴定后液面如图,则此时消耗标准溶液的体积为 。
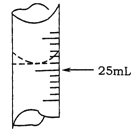
(3)乙学生做了三组平行实验,数据记录如下:
实验序号 | 待测NaOH溶液的体积/mL | 0.1000mol·L-1HCl溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 0.00 | 26.29 |
2 | 25.00 | 1.56 | 31.30 |
3 | 25.00 | 1.00 | 27.31 |
选取上述合理数据,计算出待测NaOH溶液的物质的量浓度为 (保留四位有效数字)。
(4)下列哪些操作会使测定结果偏高 (填序号)。
A.锥形瓶用蒸馏水洗净后再用待测液润洗
B.酸式滴定管用蒸馏水洗净后再用标准液润洗
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数
查看答案和解析>>
科目: 来源: 题型:
【题目】向绝热恒容密闭器中通入![]() 和
和![]() ,一定条件下使反应SO2(g)+NO2(g)SO3(g)+NO(g)达到平衡,正反应速率
,一定条件下使反应SO2(g)+NO2(g)SO3(g)+NO(g)达到平衡,正反应速率![]() 正
正![]() 随时间
随时间![]() 变化的示意图如图所示。由图可得出的正确结论是
变化的示意图如图所示。由图可得出的正确结论是
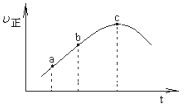
A.反应在c点达到平衡状态
B.反应物浓度:a点小于b点
C.反应物的总能量低于生成物的总能量
D.逆反应速率:c点大于b点
查看答案和解析>>
科目: 来源: 题型:
【题目】下列对分子性质的解释中,不正确的是( )
A. 碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释
B. 由于乳酸(![]() )中存在一个手性碳原子,导致该物质存在互为镜像的两个手性异构体
)中存在一个手性碳原子,导致该物质存在互为镜像的两个手性异构体
C. HF的稳定性很强,是因为其分子间能形成氢键
D. 由右图可知酸性:H3PO4>HClO,因为H3PO4分子中有1个非羟基氧原子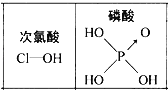
查看答案和解析>>
科目: 来源: 题型:
【题目】将等物质的量的A、B混合于2 L的密闭容器中,发生下列反应:3A(g)+B(g)xC(g)+2D(g),经2 min后测得D的浓度为0.5 mol·L-1,c(A)∶c(B)=3∶5,以C表示的平均速率v(C)=0.25 mol·L-1·min-1,下列说法正确的是( )
A. 该反应方程式中,x=1 B. 2 min时,A的物质的量为0.75 mol
C. 2 min时,A的转化率为50% D. 反应速率v(B)=0.25 mol·L-1·min-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com