
科目: 来源: 题型:
【题目】SO2是一种大气污染物,某兴趣小组欲探究SO2的性质及绿色实验方法,设计如下方案:
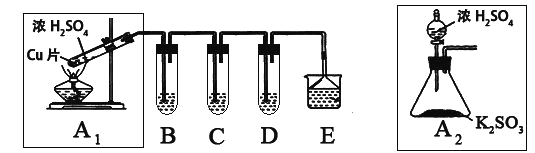
⑴ B、C、D分别用于检验SO2的漂白性、还原性和氧化性。其中C、D分别为碘水和硫化氢的水溶液,则B中所盛试剂为______________,C中反应的离子方程式为:____________________________________________。
⑵为了实现绿色实验的目标,某同学重新设计了如上右图A2的制取装置来代替A1装置,与A1装置相比,A2装置的优点是:____________________________________________________(任写一点即可)。
⑶ E中用氨水吸收尾气中的SO2,“吸收液”中可能含有OH-、SO32-、SO42-、HSO3-等阴离子。已知亚硫酸氢盐一般易溶于水,SO2也易溶于水。现有仪器和试剂为:小烧杯、试管、玻璃棒、胶头滴管、过滤装置和滤纸;2mol/L盐酸、2mol/L HNO3、1mol/L BaCl2溶液、1mol/L Ba(OH)2溶液、品红溶液、蒸馏水。请设计实验证明“吸收液”中存在SO32-和HSO3-,完成下表的实验操作、预期现象和结论:
实验操作 | 预期现象与结论 |
步骤1:取适量“吸收液”于小烧杯中,用胶头滴管取1mol/L BaCl2溶液向小烧杯滴加直至过量。 | 若出现白色浑浊,则溶液中存在SO32-或 SO42-。 |
步骤2:将小烧杯中的浊液过滤、洗涤,再用适量水把附在滤纸上的固体冲入另一小烧杯中;向冲下的固体________________________________________________________________ | _____________________ |
步骤3____________________________________________ | _________________________ |
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学对Cl2与KI溶液的反应进行了实验探究。反应装置如下:
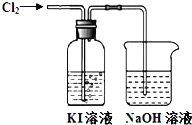
通入氯气一段时间,KI溶液变为黄色。继续通入氯气一段时间后,溶液黄色褪去,变为无色。继续通入氯气,最后溶液变为浅黄绿色。
(1)Cl2与NaOH溶液反应的化学方程式是___。
(2)KI溶液变为黄色说明氯气具有的___性,该反应的离子方程式是___。
(3)已知I2+I-![]() I3-,I2、I3-在水中均呈黄色。为确定黄色溶液的成分,进行了以下实验。
I3-,I2、I3-在水中均呈黄色。为确定黄色溶液的成分,进行了以下实验。
①实验b的目的是___。
②根据实验a中,水层中含有的粒子有___。
操作 | 实验现象 | |
a | 取2~3mL黄色溶液,加入足量CCl4,振荡静置 | CCl4层呈紫红色,水层显浅黄色 |
b | 取2~3mL饱和碘水,加入足量CCl4,振荡静置 | CCl4层呈紫红色,水层几近无色 |
③实验a中水溶液颜色变浅的原因是___。
④为保证实验的严谨性,在实验a、b的基础上,需补充一个实验,该实验为___。
(4)通入氯气,溶液由黄色变为无色,是因为氯气将I2氧化,已知1molCl2可氧化0.2molI2,该反应的化学方程式是___。
(5)根据上述实验,请预测向淀粉-KI溶液中持续通入氯气,可能观察到的现象为___。
(6)溶液最终变为浅绿色的原因是___。
查看答案和解析>>
科目: 来源: 题型:
【题目】恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应:N2 (g) + 3 H2(g) ![]() 2NH3(g)。
2NH3(g)。
(1)若反应某时刻t时,n t (N2) = 13 mol,n t (NH3) = 6 mol,则a =____mol;
(2)反应达平衡时,混合气体的体积为716.8 L(标况下),其中NH3的含量(体积分数)为25%,平衡时NH3的物质的量_____;
(3)原混合气体与平衡混合气体的总物质的量之比(写出最简整数比、下同),n(始)∶n(平) =______;
(4)原混合气体中,a∶b =_____;
(5)达到平衡时,N2和H2的转化率之比,α(N2)∶α(H2)= ______;
(6)平衡混合气体中,n(N2)∶n(H2)∶n(NH3) =______。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)铅蓄电池是最常见的二次电池,放电时的化学方程式为:Pb(s)+PbO2(s)+2H2SO4(aq)=2PbSO4(s)+2H2O(l)。该蓄电池放电时,电解质溶液中 SO42-移向_____________(填“正”或“负”)极;一段时间后,负极增重 48g,转移电子___________mol。
(2)如图是甲烷燃料电池原理示意图,回答下列问题:

①电池的负极为_____极(填“a”或“b”)。
②电池工作一段时间后电解质溶液的 pH_____(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】甲、乙两同学为探究SO2与可溶性钡的强酸盐能否反应生成白色BaSO3沉淀,用如图所示装置进行实验(夹持装置和A中加热装置已略,气密性已检验)
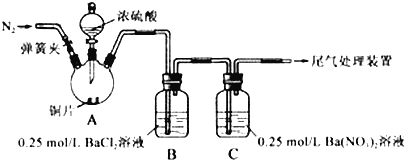
实验操作和现象:
操作 | 现象 |
关闭弹簧夹,滴加一定量浓硫酸,加热 | A中有白雾生成,铜片表面产生气泡 B中有气泡冒出,产生大量白色沉淀 C中产生白色沉淀,液面上放略显浅棕色并逐渐消失 |
打开弹簧夹,通入N2, 停止加热,一段时间后关闭 | |
从B、C中分别取少量白色沉淀,加稀盐酸 | 尚未发现白色沉淀溶解 |
(1)C中白色沉淀是___,该沉淀的生成表明SO2具有___性。
(2)C中液面上方生成浅棕色气体的化学方程式是___。
(3)分析B中不溶于稀盐酸的沉淀产生的原因,甲认为是空气参与反应,乙认为是白雾参与反应。
①为证实各自的观点,在原实验基础上:
甲在原有操作之前增加一步操作,该操作是___;乙在A、B间增加洗气瓶D,D中盛放的试剂是___。
②进行实验,B中现象:
甲 | 大量白色沉淀 |
乙 | 少量白色沉淀 |
检验白色沉淀,发现均不溶于稀盐酸。结合离子方程式解释实验现象异同的原因:___。
(4)合并(3)中两同学的方案进行试验。B中无沉淀生成,而C中产生白色沉淀,由此得出的结论是___。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A.水是弱电解质,电离方程式为H2O+H2O![]() H3O++OH-
H3O++OH-
B.常温下,向水中加入H2SO4溶液,H+ 浓度增大,Kw增大
C.将纯水加热到100℃,pH≈6,显酸性
D.常温下,将0.1mol·L-1的 NaOH溶液体积稀释到原来的10倍,则pH=12
查看答案和解析>>
科目: 来源: 题型:
【题目】已知下列热化学方程式:
①H2(g)+![]() O2(g)=H2O(l) ΔH=-285.8 kJ/mol
O2(g)=H2O(l) ΔH=-285.8 kJ/mol
②H2(g)+![]() O2(g)=H2O(g) ΔH=-241.8 kJ/mol
O2(g)=H2O(g) ΔH=-241.8 kJ/mol
③C(s)+![]() O2(g)=CO(g) ΔH=-110.5 kJ/mol
O2(g)=CO(g) ΔH=-110.5 kJ/mol
④C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ/mol
回答下列问题:
(1)上述反应中属于放热反应的是_______。
(2)H2的燃烧热为_______,C的燃烧热为_______。
(3)燃烧10 g H2生成液态水,放出的热量为_______。
(4)CO的燃烧热为_____________,其热化学方程式为________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某实验小组用如图所示装置进行实验以探究Fe3+、Cl2和SO2的氧化性强弱(夹持仪器已略)。
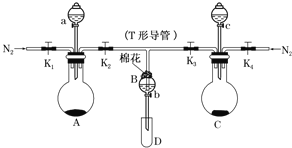
(1)按图连接好装置,检查A装置的气密性的方法为___。
(2)检查完装置的气密性,添加药品,向A装置的分液漏斗中加入浓盐酸,在圆底烧瓶中加入固体KMnO4;向B装置中加入10mLFeCl2溶液;在C装置的分液漏斗中加入70%的硫酸,向圆底烧瓶中加入固体Na2SO3;棉花浸润___溶液。打开弹簧夹K1~K4,通入一段时间N2,再将T形导管插入B中,继续通入N2,然后关闭K1,K3,K4。通入一段时间N2的目的是___。
(3)打开活塞a,逐滴加入浓盐酸,当B中溶液变为棕黄色时,停止滴加浓盐酸,夹紧K2,打开活塞b,使约2mL的溶液流入D试管中,分别取1mL溶液滴入___(填试剂名称)和铁氰化钾溶液可以证明其中含有Fe3+和Fe2+。A装置中发生反应的离子方程式为___。
(4)打开K3和活塞c,逐滴加入70%的硫酸,当B中溶液颜色逐渐变为___色,停止滴加70%的硫酸,夹紧K3,打开活塞b,使约2mL的溶液流入D试管中,并检验其中的离子。B中发生反应的离子方程式为___。
(5)结合实验现象判断Fe3+、Cl2、SO2氧化性由弱到强的顺序为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)写出下列物质在水溶液中电离的方程式:
HNO3__;
HClO__;
NaHCO3__、___。
(2)在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、W 是原子序数依次增大的前四周期元素,X、Z的周期序数=族序数,W的原子序数是 Z的两倍,由这四种元素组成的单质或化合物存在如图所示的转化关系,其中甲、戊是两种常见的金属单质,丁是非金属单质,其余为氧化物且丙为具有磁性的黑色 晶体。下列说法正确的是
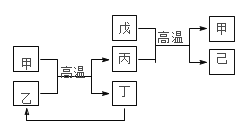
A.W金属性强于 Z
B.W 元素在周期表中的位置是第四周期 VIII 族
C.丙属于两性氧化物
D.等物质的量的甲和戊完全溶于稀硝酸,消耗的 HNO3的量一定相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com