
科目: 来源: 题型:
【题目】明代《天工开物》记载了“火法”冶炼锌的方法:“炉甘石十斤,装载入一泥罐内,…然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,…冷淀,毁罐取出,…,即倭铅也”,现代工业开发了用NH3—NH4Cl水溶液浸出氧化锌烟灰(主要成分为ZnO 、少量Pb、CuO和As2O3)制取高纯锌的工艺流程如图所示。
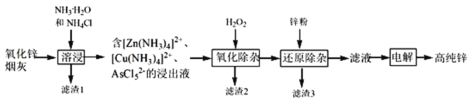
请回答下列问题:
(1)《天工开物》中炼锌的方法中“泥封”的目的是____________。
(2)滤渣1的主要成份分别是_______(填化学式),“过滤”用到的玻璃仪器是__________。
(3) “溶浸”时,氧化铜参与反应的相关离子方程式是________;“溶浸”时可以适当升高温度,但不宜过高,其原因是________________。
(4) “氧化除杂”的目的是将AsCl52-转化为As2O5胶体,再经吸附聚沉除去,溶液始终接近中性,该反应的离子方程式是_____________________。
(5) “电解”含 [Zn(NH3)4]2+的溶液,阴极放电的电极反应式是_________。阳极区产生一种无色无味的气体,将其通入滴有KSCN的FeCl2溶液中,无明显现象,该气体是_______(写化学式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某校化学研究性学习小组探究足量的镁与浓硫酸反应。回答下列问题:
Ⅰ.甲同学设计如图实验验证该过程产生的混合气体中含有![]() 、
、![]() 。
。
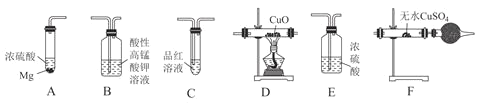
![]() 若按气体从左到右的流向,各装置的连接顺序是________
若按气体从左到右的流向,各装置的连接顺序是________![]() 填字母编号
填字母编号![]() 。
。
![]() 已知装置A中浓硫酸的质量分数为90%,密度ρ=1.47g/mL,该浓硫酸的物质的量浓度为________mol/L。
已知装置A中浓硫酸的质量分数为90%,密度ρ=1.47g/mL,该浓硫酸的物质的量浓度为________mol/L。
![]() 装置C的作用是________。
装置C的作用是________。
![]() 证明混合气体中含有H2的实验现象为________。
证明混合气体中含有H2的实验现象为________。
Ⅱ.乙同学设计如图实验测定混合气体中SO2的含量。

![]() 溶液可以是________
溶液可以是________![]() 填字母
填字母![]() 。
。
![]() 溶液
溶液
![]() 酸性
酸性![]() 溶液
溶液![]() 硫酸酸化
硫酸酸化![]()
![]() 溴水
溴水
![]() 步骤
步骤![]() 中洗涤沉淀的操作为________。
中洗涤沉淀的操作为________。
![]() 通过的混合气体体积为VL(已换算成标准状况)时,该混合气体中二氧化硫的含量
通过的混合气体体积为VL(已换算成标准状况)时,该混合气体中二氧化硫的含量![]() 体积分数
体积分数![]() 为________
为________![]() 用含V、m的代数式表示
用含V、m的代数式表示![]() 。
。
查看答案和解析>>
科目: 来源: 题型:
【题目】青花瓷,俗称青花,是中国瓷器的主流品种之一。某同学利用如下方法来粗略测定青花瓷瓶的容积,把![]() NaCl晶体放入到500mL烧杯中,加入200mL蒸馏水,待NaCl完全溶解后,将溶液
NaCl晶体放入到500mL烧杯中,加入200mL蒸馏水,待NaCl完全溶解后,将溶液![]() 包括洗涤液
包括洗涤液![]() 全部转移到该瓶中,用蒸馏水稀释至完全充满容器。从中取出100mL溶液,该溶液恰好能与10mL
全部转移到该瓶中,用蒸馏水稀释至完全充满容器。从中取出100mL溶液,该溶液恰好能与10mL![]() 的
的![]() 溶液完全反应。则下列说法正确的是( )
溶液完全反应。则下列说法正确的是( )
A.该青花瓷瓶的容积约为![]()
B.常温下,该青花瓷瓶几乎能容纳56kg![]()
C.常温常压下,该青花瓷瓶能容纳70g![]()
D.标准状况下,充满HCl气体,加满水后所得溶液物质的量浓度为![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】氰化钠![]() 是重要的化工原料,易溶于水,易水解生成氰化氢,剧毒物质。常用于电镀、冶金、有机合成医药、络合剂和掩蔽剂。
是重要的化工原料,易溶于水,易水解生成氰化氢,剧毒物质。常用于电镀、冶金、有机合成医药、络合剂和掩蔽剂。
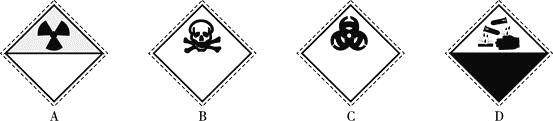
![]() 装氰化钠
装氰化钠![]() 试剂瓶的标签上应印有下列警示标记中的________
试剂瓶的标签上应印有下列警示标记中的________![]() 填序号
填序号![]() 。
。
![]() 实验室用NaCN固体配制NaCN溶液时,为避免其水解,应先将其溶于______________浓溶液,再用蒸馏水稀释。
实验室用NaCN固体配制NaCN溶液时,为避免其水解,应先将其溶于______________浓溶液,再用蒸馏水稀释。
![]() 泄漏时用双氧水处理以减轻环境污染,处理后生成一种酸式盐和一种能使湿润的红色石蕊试纸变蓝的气体,该反应的离子方程式是__________________________________________。
泄漏时用双氧水处理以减轻环境污染,处理后生成一种酸式盐和一种能使湿润的红色石蕊试纸变蓝的气体,该反应的离子方程式是__________________________________________。
![]() 化学兴趣小组利用:2NH
化学兴趣小组利用:2NH![]() 反应原理制备NaCN并检测其纯度。
反应原理制备NaCN并检测其纯度。
实验一:制备NaCN装置如图所示
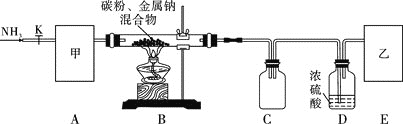
![]() 装置C的作用是____________。甲可选取下列装置中的________
装置C的作用是____________。甲可选取下列装置中的________![]() 填序号
填序号![]() 。
。

![]() 安装好实验仪器,检查装置气密性,取一定量的碳粉与金属钠混合,放入硬质玻璃管内;接下来的操作正确的是________
安装好实验仪器,检查装置气密性,取一定量的碳粉与金属钠混合,放入硬质玻璃管内;接下来的操作正确的是________![]() 填序号
填序号![]() 。
。
A.先打开活塞K,缓缓通入一段时间氨气后再加热硬质玻璃管
B.先加热硬质玻璃管,再打开活塞K,缓缓通入氨气
C.打开活塞K,一边缓缓通入氨气,同时加热硬质玻璃管
![]() 上述装置中乙处还需补充的实验仪器或装置有__________________。
上述装置中乙处还需补充的实验仪器或装置有__________________。
实验二:测定产品中氰化钠的含量
![]() 已知: Ag
已知: Ag![]() ,Ag
,Ag![]() ,AgI呈黄色,且CN
,AgI呈黄色,且CN![]() 优先与Ag
优先与Ag![]() 反应。取制备好的产品
反应。取制备好的产品![]() ,配成
,配成![]() 溶液,取
溶液,取![]() 于锥形瓶中,并滴加
于锥形瓶中,并滴加![]() 滴KI溶液作指示剂,用
滴KI溶液作指示剂,用![]() 的标准AgNO
的标准AgNO![]() 溶液滴定3次,平均消耗AgNO
溶液滴定3次,平均消耗AgNO![]() 溶液的体积为
溶液的体积为![]() 。滴定终点的现象是____________________________________________________________,产品氰化钠的纯度为________
。滴定终点的现象是____________________________________________________________,产品氰化钠的纯度为________![]() 。
。
查看答案和解析>>
科目: 来源: 题型:
【题目】以铬矿石(主要成分为Cr2O3,还有Al2O3、SiO2等杂质)为原料制取红矾钠 (Na2Cr2O7·2H2O)的流程如图所示。

已知:I.Cr2O3在碱性条件下易被氧化;
II.高温条件下,Al2O3与Na2CO3发生的反应为:Al2O3 +Na2CO3=2NaAlO2 +CO2↑;
III.2CrO42-+2H+![]() Cr2O72- +H2O K=1.0×1012
Cr2O72- +H2O K=1.0×1012
(1)“煅烧”时,Cr2O3参加反应的化学方程式为_____。若“煅烧”操作最适宜的温度是800~900℃,则在实验室中进行此项操作时,应选择_____坩埚(填字母)。
a.陶瓷 b.玻璃 c.石英 d.铁
(2)流程中可循环利用的物质除CO2外还有_____(填化学式)。
(3)“过滤II”所得沉淀主要有______(填化学式)。
(4)由Na2Cr2O7溶液制备红矾钠的具体实验操作有_____,经洗涤、干燥得到红矾钠样品。
(5)“电解”时,利用以下装置将Na2CrO4溶液转化为Na2Cr2O7溶液,当a、b均为石墨电极时,a电极的电极反应式为____。若初始加入电解池中的c (Na2CrO4)=1.0mol·L-l,随着“电解”的进行,当溶液pH=6时,Na2CrO4的转化率为______(忽略电解过程中溶液体积变化)。

查看答案和解析>>
科目: 来源: 题型:
【题目】水的电离平衡曲线如图所示,下列说法正确的是
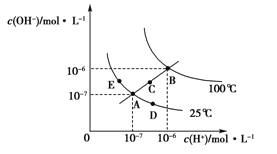
A. 图中五点KW间的关系:B>C>A=D=E
B. 若从A点到D点,可采用在水中加入少量NaOH的方法
C. 若从A点到C点,可采用温度不变时在水中加入适量H2SO4 的方法
D. 若处在B点时,将pH=2的硫酸与pH=12的KOH等体积混合后,溶液显中性
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)实验室用金属铜和稀硝酸制取NO的离子方程式____________________________
(2)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图甲所示。
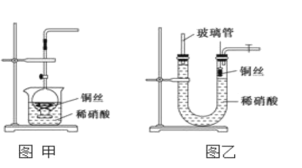
①实验室若没有铜丝,而只有小铜粒,在使用上述装置进行实验时,可用丝状材料包裹铜粒以代替铜丝进行实验,这种丝状材料的成分可以是________(填序号)。
A.铁 B.铝 C.铂 D.玻璃
②打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的,原因是______________________________________(填化学方程式)。
(3)为证明铜丝与稀硝酸反应生成的确实是NO,某学生另设计了一套如图乙所示的装置制取NO。反应开始后,可以在U形管右端观察到无色的NO气体。
①长玻璃管的作用是________________________________。
②让反应停止的操作方法及原因是_________________。
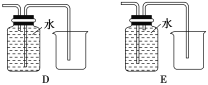
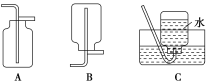
(4)以下收集NO气体装置,不合理的是____(填序号)。
查看答案和解析>>
科目: 来源: 题型:
【题目】叠氮化钠(NaN3)是一种白色剧毒晶体,是汽车安全气囊的主要成分。NaN3易溶于水,微溶于乙醇,水溶液呈弱碱性,能与酸发生反应产生具有爆炸性的有毒气体叠氮化氢。实验室可利用亚硝酸叔丁酯(t-BuNO2,以t-Bu表示叔丁基)与N2H4、氢氧化钠溶液混合反应制备叠氮化钠。
(1)制备亚硝酸叔丁酯
取一定NaNO2溶液与50%硫酸混合,发生反应H2SO4+2NaNO2===2HNO2+Na2SO4。可利用亚硝酸与叔丁醇(t-BuOH)在40 ℃左右制备亚硝酸叔丁酯,试写出该反应的化学方程式:________________。
(2)制备叠氮化钠(NaN3)
按如图所示组装仪器(加热装置略)进行反应,反应方程式为:t-BuNO2+NaOH+N2H4===NaN3+2H2O+t-BuOH。

①装置a的名称是________________;
②该反应需控制温度在65 ℃,采用的实验措施是____________________;
③反应后溶液在0 ℃下冷却至有大量晶体析出后过滤,所得晶体使用无水乙醇洗涤。试解释低温下过滤和使用无水乙醇洗涤晶体的原因是______________________________________________。
(3)产率计算
①称取2.0 g叠氮化钠试样,配成100 mL溶液,并量取10.00 mL溶液于锥形瓶中。
②用滴定管加入0.10 mol·L-1六硝酸铈铵[(NH4)2Ce(NO3)6]溶液40.00 mL[发生的反应为2(NH4)2Ce(NO3)6+2NaN3===4NH4NO3+2Ce(NO3)3+2NaNO3+3N2↑](假设杂质均不参与反应)。
③充分反应后将溶液稀释并酸化,滴入2滴邻菲罗啉指示液,并用0.10 mol·L-1硫酸亚铁铵[(NH4)2Fe(SO4)2]为标准液,滴定过量的Ce4+,终点时消耗标准溶液20.00 mL(滴定原理:Ce4++Fe2+===Ce3++Fe3+)。计算可知叠氮化钠的质量分数为__________(保留2位有效数字)。若其他操作及读数均正确,滴定到终点后,下列操作会导致所测定样品中叠氮化钠质量分数偏大的是______(填字母代号)。
A.锥形瓶使用叠氮化钠溶液润洗
B.滴加六硝酸铈铵溶液时,滴加前仰视读数,滴加后俯视读数
C.滴加硫酸亚铁铵标准溶液时,开始时尖嘴处无气泡,结束时出现气泡
D.滴定过程中,将挂在锥形瓶壁上的硫酸亚铁铵标准液滴用蒸馏水冲进瓶内
(4)叠氮化钠有毒,可以使用次氯酸钠溶液对含有叠氮化钠的溶液进行销毁,反应后溶液碱性明显增强,且产生无色无味的无毒气体,试写出反应的离子方程式:____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】无水![]() 广泛用作有机反应催化剂。实验室采用镁屑与液溴为原料制备无水
广泛用作有机反应催化剂。实验室采用镁屑与液溴为原料制备无水![]() ,装置如图1,主要步骤如下:
,装置如图1,主要步骤如下:
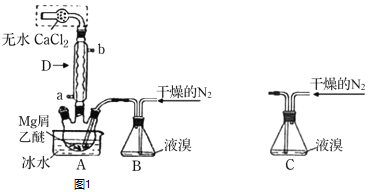
步骤1三颈瓶中装入10g镁屑和150mL无水乙醚;装置B中加入15mL液溴。
步骤2缓慢通入干燥的氮气,直至溴完全导入三颈瓶中。
步骤3反应完毕后恢复至室温,过滤,滤液转移至另一干燥的烧瓶中,冷却至![]() ,析出晶体,再过滤得三乙醚合溴化镁粗品。
,析出晶体,再过滤得三乙醚合溴化镁粗品。
步骤4常温下用苯溶解粗品,冷却至![]() ,析出晶体,过滤,洗涤得三乙醚合溴化镁,加热至
,析出晶体,过滤,洗涤得三乙醚合溴化镁,加热至![]() 分解得无水
分解得无水![]() 产品。
产品。
已知:![]() 和
和![]() 反应剧烈放热;乙醚
反应剧烈放热;乙醚![]() 极易挥发;
极易挥发;
![]() 具有强吸水性。
具有强吸水性。
![]()
![]()
![]()
请回答下列问题:
![]() 仪器D的名称是___________________。冷凝水应该从________
仪器D的名称是___________________。冷凝水应该从________![]() 填a或
填a或![]() 口通入;
口通入;
![]() 干燥的
干燥的![]() 可将液溴吹出,是因为液溴具有___________的性质;实验中不能用干燥空气代替干燥
可将液溴吹出,是因为液溴具有___________的性质;实验中不能用干燥空气代替干燥![]() ,原因是___________;
,原因是___________;
![]() 将装置B改为装置C,可能会导致的后果是_____________________________;
将装置B改为装置C,可能会导致的后果是_____________________________;
![]() 步骤3中,第一次过滤除去的物质是___________________________________;
步骤3中,第一次过滤除去的物质是___________________________________;
![]() 试用平衡移动的原理说明得到三乙醚合溴化镁后,加热有利于其分解,得无水
试用平衡移动的原理说明得到三乙醚合溴化镁后,加热有利于其分解,得无水![]() 产品的原因:__________________________;
产品的原因:__________________________;
![]() 为测定产品的纯度,可用EDTA标准溶液滴定,反应的离子方程式:
为测定产品的纯度,可用EDTA标准溶液滴定,反应的离子方程式:![]() ;测定前,先称取
;测定前,先称取![]() 无水
无水![]() 产品,溶解后,用0.0500mol/L的EDTA标准溶液滴定至终点,消耗EDTA标准溶液20.00mL,则测得无水
产品,溶解后,用0.0500mol/L的EDTA标准溶液滴定至终点,消耗EDTA标准溶液20.00mL,则测得无水![]() 产品的纯度是_________________
产品的纯度是_________________![]() 以质量分数表示
以质量分数表示![]() 。
。
查看答案和解析>>
科目: 来源: 题型:
【题目】二氧化钛在一定波长光的照射下,可有效降解甲醛、苯等有机物,效果持久,且自身对人体无害。某课题组研究了溶液的酸碱性对TiO2光催化染料R降解反应的影响,结果如图所示。下列判断正确的是

A. 在0~20min之间,pH=7时R的降解速率为0.07mol·L-1·min-1
B. R的起始浓度不同,无法判断溶液的酸碱性对R的降解速率的影响
C. 二氧化钛对pH=2的R溶液催化效率好
D. 在0~50 min之间,R的降解百分率pH=2大于pH=7
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com