
科目: 来源: 题型:
【题目】苯甲醛(微溶于水、易溶于有机溶剂,密度约等于水的密度)在碱性条件下发生歧化反应可以制备苯甲醇(在水中溶解度不大、易溶于有机溶剂,密度约等于水的密度)和苯甲酸。反应原理如下:2C6H5CHO+NaOH→C6H5CH2OH+C6H5COONa,C6H5COONa+HCl→C6H5COOH+NaCl。有关物质物理性质如表:
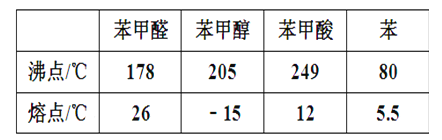
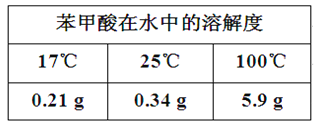
实验流程如下:

(1)第①步需连续加热1小时(如图1),其中加热和固定装置未画出。若将仪器B改为仪器C,效果不如B,说明原因__。
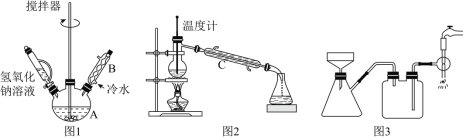
(2)操作中有关分液漏斗的使用不正确的是__。
A.分液漏斗在使用之前必须检查是否漏水
B.分液漏斗内的液体不能过多,否则不利于振荡
C.充分振荡后将分液漏斗置于铁架台上静置,分层后立即打开旋塞进行分液
D.分液时等下层液体放完后立即关闭旋塞,换一个烧杯再打开旋塞使上层液体流下
(3)操作③用沸水浴加热蒸馏,再进行操作④(如图2),收集_℃的馏分。图2中有一处明显错误,正确的应改为__。
(4)抽滤时(如图3)烧杯中苯甲酸晶体转入布氏漏斗时,杯壁上还粘有少量晶体,__冲洗杯壁上残留的晶体,抽滤完成后洗涤晶体。
(5)用电子天平准确称取0.2440g苯甲酸样品于锥形瓶中,加100mL蒸馏水溶解(必要时可以加热),再用0.1000molL-1的标准NaOH溶液滴定,共消耗NaOH溶液19.20mL,则苯甲酸样品的纯度为__%(保留4位有效数字)。
查看答案和解析>>
科目: 来源: 题型:
【题目】元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中R为元素周期表中的电负性最强的元素。则下列判断正确的是( )
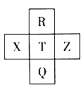
A.非金属性:Z<T<X
B.R与Q的电子数相差24
C.气态氢化物的沸点:R<T<Q
D.最高价氧化物的水化物的酸性:T>Q
查看答案和解析>>
科目: 来源: 题型:
【题目】下列事实不能用化学平衡移动原理解释的是
A.收集氯气可以用排饱和食盐水的方法
B.在一定条件下,氢气与碘蒸汽反应达平衡后,加压,混合气体颜色变深
C.可用浓氨水和氢氧化钠固体快速制取氨气
D.合成三氧化硫过程中使用过量的氧气,以提高二氧化硫的转化率
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法不正确的是

A. 加水稀释可以使溶液由c点变到d点
B. 此温度时,Ksp(BaSO4)=1.1×10-10
C. b点有BaSO4沉淀析出
D. a点对应的Ksp等于c点对应的Ksp
查看答案和解析>>
科目: 来源: 题型:
【题目】一种三室微生物燃料电池污水净化系统原理如下图所示,图中含酚废水中有机物可用C6H6O表示,左、中、右室间分别以离子交换膜分隔。下列说法不正确的是( )

A. 左池的pH值降低
B. 右边为阴离子交换膜
C. 右池电极的反应式:2NO3-+10e-+12H+= N2↑+ 6H2O
D. 当消耗0.1molC6H6O,在标准状况下将产生0.28mol氮气
查看答案和解析>>
科目: 来源: 题型:
【题目】1,2—二溴乙烷是一种无色液体,有挥发性,有毒,难溶于水,沸点为132℃,密度为2.2gmL-1。某研究性学习小组的同学利用如图(加热装置省略)装置制备一定量的1,2—二溴乙烷,制备原理为:C2H5OH→C2H4→CH2BrCH2Br。Y中的浓硫酸是催化剂、脱水剂,乙醇的密度为0.8gmL-1。
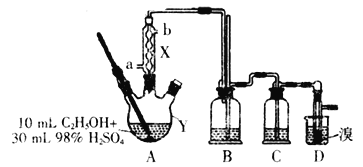
(1)仪器Y的名称是__,由乙醇制备乙烯需要控制温度在170℃,使用X的目的是__,实验中加热A与向X中通入冷却剂的顺序是__。
(2)实验时Y中液体会变成黑色,并有刺激性气味的无机气体产生,变成黑色的原因是__,为吸收反应中生成的无机气体,在装置C中应加入__。
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)写出D中反应的化学方程式:__;若产物中有少量未反应的Br2,最好用___洗涤除去。
a.水 b.Na2CO3溶液 c.碘化钠溶液 d.乙醇
(4)该套装置存在一个明显的不足,不足之处是__。
(5)若得到ag1,2—二溴乙烷,所用乙醇的利用率为__。
查看答案和解析>>
科目: 来源: 题型:
【题目】芳香羧酸通常用芳香烃的氧化来制备,某同学用甲苯的氧化反应制备苯甲酸。已知:![]() +2KMnO4
+2KMnO4![]() +KOH+2MnO2↓+H2O
+KOH+2MnO2↓+H2O
反应试剂、产物的物理常数:
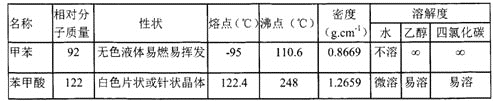
主要实验装置和流程如下:
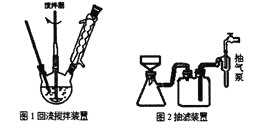
实验方法:向图1装置中依次加入2.8mL甲苯、200mL水和8.6g高锰酸钾,通冷凝水,加热至沸腾,在反应过程中,甲苯不断的被冷凝回流,反应结束后,按以下步骤操作,得到苯甲酸粗产品。
![]()
(1)图1装置中反应结束的标志是__,趁热抽滤的目的是__。
(2)写出浓盐酸酸化时的所有离子反应方程式__。
(3)下列说法正确的是__。
A.图1装置中的反应混合物抽滤时应用玻璃砂漏斗替代布氏漏斗
B.在冷却抽滤时,若有产品黏在瓶壁上,可用滤液淋洗,直到所有晶体收集到布氏漏斗中,再次抽滤
C.苯甲酸粗产品的杂质除KCl外还可能含有甲苯,均可用蒸馏水洗涤除去
D.抽滤结束,为防止倒吸,应先关闭水龙头,再拆掉抽气泵和吸滤瓶之间的橡皮管
(4)苯甲酸纯度测定:用__(填仪器名称)称取1.220g产品,加合适溶剂溶解,再用蒸馏水稀释配成100mL溶液,取25.00mL溶液,滴加几滴指示剂,用0.1000molL-1NaOH标准液进行滴定,平行滴定3次,平均消耗标准液体积为21.00mL
①“合适溶剂”和“指示剂”分别为__。
A.蒸馏水和酚酞 B.乙醇和甲基橙 C.四氯化碳和酚酞 D.乙醇和酚酞
②苯甲酸产品的纯度为__。
查看答案和解析>>
科目: 来源: 题型:
【题目】对氯苯氧乙酸是一种具有生长素活性的苯氧类植物生长调节剂。实验室合成原理为:![]() +ClCH2COOH+2NaOH
+ClCH2COOH+2NaOH![]() +NaCl+H2O
+NaCl+H2O
![]() +HCl
+HCl![]() +NaCl
+NaCl
制备过程存在副反应:ClCH2COOH+2NaOH![]() HOCH2COONa+NaCl+H2O
HOCH2COONa+NaCl+H2O
已知相关物质的物理性质:
名称 | 氯乙酸 | 对氯苯酚 | 对氯苯氧乙酸 |
性状 | 无色晶体 | 无色晶体 | 白色晶体 |
水 | 易溶 | 极微溶 | 微溶 |
乙醇 | 易溶 | 溶 | 易溶 |
乙醚 | 易溶 | 溶 | 易溶 |
主要实验装置和步骤如下:
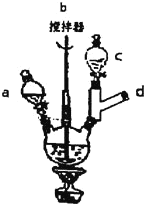
Ⅰ.合成:在三颈烧瓶中加入10mL20%的NaOH溶液、6.4g对氯苯酚和0.5gKI。称取5.3g氯乙酸溶于蒸馏水并移入c中,在a中加入15mL20%的NaOH溶液。加热和搅拌装置,然后慢慢滴加氯乙酸和NaOH溶液,滴加完毕后继续搅拌加热半小时。反应结束后,趁热将反应液倒入烧瓶中,加盐酸至pH为1左右,用冰水冷却使晶体析出,抽滤,洗涤,得粗产品。
Ⅱ.提纯
粗产品![]() 滤液
滤液![]() 少量固体析出
少量固体析出![]()
回答下列问题:
(1)d处应接的装置是__。
(2)合成过程中要在不断搅拌下滴加氯乙酸和NaOH溶液的原因是__。
(3)试剂X是__。
(4)趁热过滤除去的杂质的化学式是__。
(5)提纯步骤中,洗涤抽滤得到的晶体应选用的洗涤剂是__。
查看答案和解析>>
科目: 来源: 题型:
【题目】2019年诺贝尔化学奖授予在开发锂离子电池方面做出卓越贡献的三位化学家。锂离子二次电池正极铝钴膜主要含有LiCoO2、A1等,处理该废料的一种工艺如下图所示,下列说法正确的是
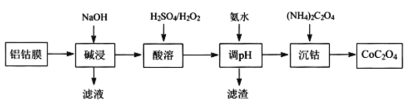
A.酸溶时H2O2做氧化剂,且温度不宜过高
B.加氨水调pH的目的是除铝
C.沉钴的离子方程式为:Co2++C2O42-=CoC2O4↓
D.在空气中加热4.41gCoC2O4得到钴的氧化物2.41g,则该氧化物的化学式为Co3O4
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
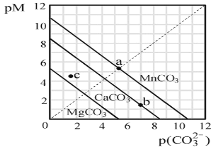
已知pM=-lgc(M),p(CO![]() )=-lgc(CO
)=-lgc(CO![]() )。
)。
A.MgCO3、CaCO3、MnCO3的Ksp依次增大
B.a点可表示MnCO3的饱和溶液,且c(Mn2+)=c(CO![]() )
)
C.b点可表示CaCO3的饱和溶液,且c(Ca2+)<c(CO![]() )
)
D.c点可表示MgCO3的过饱和溶液,且c(Mg2+)<c(CO![]() )
)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com