
科目: 来源: 题型:
【题目】元素周期律(表)是认识元素化合物性质的重要理论。
(1)某学习小组研究了金属锂、钠、镁的性质后发现:
ⅰ.锂、镁和水反应均较为微弱,钠和水反应较为剧烈
ⅱ.锂和镁的氢氧化物均为中等强度的碱
ⅲ.锂、镁在空气中燃烧均生成氧化物,而钠在空气中燃烧生成过氧化物
根据以上事实,可知锂、钠、镁三种元素的金属性强弱关系是___________________(用“>”“=”或“<”)。
(2)锶(38Sr)元素广泛存在于矿泉水中,是一种人体必需的微量元素,在元素周期表中与20Ca和56Ba同属于第ⅡA族。
①碱性:Sr(OH)2_____ Ba (OH)2(填“>”或“<”)。
②用原子结构的观点解释锶的化学性质与钡差异的原因:______________________________
(3)硒(Se)的部分信息如图,且知34Se、35Br位于同一周期。
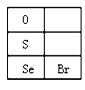
①Se在元素周期表中的位置是_______________。
②H2Se的电子式是______________。
③Cl、Se、Br的非金属性强弱的顺序是__________________;能证明上述强弱关系的事实是____________________________(写出一条即可)。
④某同学对SeO2(白色的挥发性固体,易溶于水)的各种不同化学性质进行推测,并用SO2水溶液、H2O2溶液、NaOH溶液、稀H2SO4等试剂进行实验,证明了推测是正确的。完成下表:
编号 | 性质推测 | 化学方程式 |
1 | 氧化性 | SeO2+2SO2+2H2O=Se+2H2SO4 |
2 | ____________ | ______________ |
3 | ___________ | ____________ |
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式中,不能正确表达反应颜色变化的是( )
A.向氯水中通入SO2气体,溶液浅黄绿色消失:Cl2 + SO2 + 2 H2O = 4H+ + 2Cl- + SO42-
B.向AgNO3溶液中加入一定量HCl溶液,后加入Na2S溶液,白色沉淀变黑色:2AgCl + S2- = Ag2S + 2Cl-
C.向氢氧化铁胶体中加入HI酸溶液,首先出现红褐色沉淀,后沉淀消失,溶液变为黄色:2Fe(OH)3 + 6H+ + 2I- = 2Fe2+ + I2 + 6H2O
D.向CrO42-中加入H2SO4溶液,颜色由黄色变为橙色:2CrO42-+2H+![]() Cr2O72-+H2O
Cr2O72-+H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】一种利用铝土矿(含有氧化铝和杂质)生产氧化铝纯品的工业流程如下:
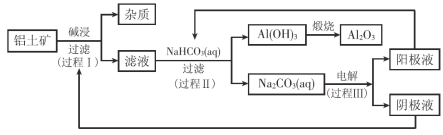
(1)过程I,发生反应的离子方程式是 。
(2)过程II,用一定浓度的NaHCO3溶液处理碱浸后滤液,所得溶液pH和Al(OH)3生成的量随加入NaHCO3溶液体积变化的曲线如下:
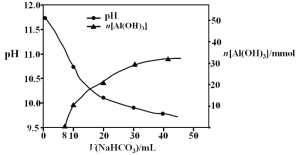
① 加入NaHCO3溶液体积小于8 mL时,发生主要反应的离子方程式是 。
② 过程II生成Al(OH)3的离子方程式是 。
(3)过程III,电解Na2CO3溶液的装置如下图所示。
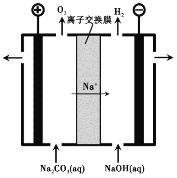
① 阴极的电极反应式是 。
② 简述阳极液生成的原理: 。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列物质的转化在给定条件下能实现的是( )
①盐卤(含MgCl2)![]() Mg(OH)2
Mg(OH)2![]() MgCl2溶液
MgCl2溶液![]() 无水MgCl2
无水MgCl2
②铝土矿![]() AlO2-
AlO2-![]() Al(OH)3
Al(OH)3![]() Al2O3
Al2O3
③NH3![]() NO
NO![]() NO2
NO2![]() HNO3
HNO3
④NaCl溶液![]() Cl2
Cl2![]() 无水FeCl2
无水FeCl2
⑤S![]() SO3
SO3![]() H2SO4
H2SO4
⑥SiO2![]() Na2SiO3溶液
Na2SiO3溶液![]() H2SiO3
H2SiO3
A. ③⑥B. ③⑤⑥C. ①④⑤D. ①③⑥
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求回答下列问题:
(1)常温下向一定体积的0.1mol/L醋酸溶液中加水稀释后,下列说法正确的是___。
A.溶液中导电粒子的数目减少 B.醋酸的电离程度增大,c(H+)亦增大
C.溶液中![]() 不变 D.溶液中
不变 D.溶液中![]() 减小
减小
(2)常温下将0.15mol/L稀硫酸V1mL与0.1mol/L NaOH溶液V2mL混合,所得溶液的pH为1,则V1:V2=___(溶液体积变化忽略不计)。
(3)常温下,某溶液中由水电离产生的c(H+)=1×10-11 mol·L-1,则该溶液的pH可能是___。
(4)常温下,在pH=9的CH3COONa溶液中,由水电离出的OH-浓度___。
(5)电解质水溶液中存在电离平衡、水解平衡,请回答下列问题。
已知部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
电离平衡常数(25℃) | Ka=1.77×10-4 | Ka=5.0×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
①同浓度HCOONa、NaCN、NaHCO3、Na2CO3这4种溶液中碱性最强的是__;
②体积相同、c(H+)相同的三种酸溶液a.HCOOH;b.HCN;c.HCl分别与同浓度的NaOH溶液完全中和,消耗NaOH溶液的体积由大到小的排列顺序是(填字母) __。
查看答案和解析>>
科目: 来源: 题型:
【题目】科学家合成出了一种新化合物(如图所示),其中W、X、Y、Z为同一短周期元素,Z核外最外层电子数是X核外电子数的一半。下列叙述正确的是

A. WZ的水溶液呈碱性
B. 元素非金属性的顺序为X>Y>Z
C. Y的最高价氧化物的水化物是中强酸
D. 该新化合物中Y不满足8电子稳定结构
查看答案和解析>>
科目: 来源: 题型:
【题目】某兴趣小组以海水晒盐后的苦囟![]() 含有
含有![]() 为原料,设计制备碘单质
为原料,设计制备碘单质![]() 的转化途径如图,下列说法不正确的是
的转化途径如图,下列说法不正确的是

A.生活中可直接使用![]() 淀粉试纸检验加碘盐中是否含有碘
淀粉试纸检验加碘盐中是否含有碘
B.途径Ⅲ发生反应的离子方程式可能是![]()
C.由图可知氧化性的强弱顺序为![]()
D.两种途径得到等量的碘,消耗氯气物质的量比为1:5
查看答案和解析>>
科目: 来源: 题型:
【题目】如果定义有机物的同系列是一系列结构式符合![]() (其中n=0、1、2、3……)的化合物。式中A、B是任意一种基团(或氢原子),W为2价的有机基团,又称为该同系列的系差。同系列化合物的性质往往呈现规律性变化。下列四组化合物中,不可称为同系列的是
(其中n=0、1、2、3……)的化合物。式中A、B是任意一种基团(或氢原子),W为2价的有机基团,又称为该同系列的系差。同系列化合物的性质往往呈现规律性变化。下列四组化合物中,不可称为同系列的是
A.CH3CH2CH2CH3 CH3CH2CH2CH2CH3 CH3CH2CH2CH2CH2CH3
B.CH3CH=CHCHO CH3CH=CHCH=CHCHO CH3(CH=CH)3CHO
C.CH3CH2CH3 CH3CHClCH2CH3 CH3CHClCH2CHClCH3
D.ClCH2CHClCCl3 ClCH2CHClCH2CHClCCl3 ClCH2CHClCH2CHClCH2CHClCCl3
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验。
Ⅰ.(1)将钠、钾、镁、铝各1 mol分别投入到足量的0.1 mol·L-1的盐酸中,试预测实验结果:_______与盐酸反应最剧烈,______与盐酸反应最慢。
(2)将NaOH溶液与NH4Cl溶液混合生成NH3·H2O,从而验证NaOH的碱性大于NH3·H2O,继而可以验证Na的金属性大于N,你认为此设计_______(填“合理”或“不合理”),说明理由:___________。
Ⅱ.利用下图装置可以验证非金属性的变化规律。
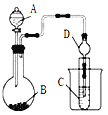
(3)仪器A的名称为_________,干燥管D的作用是________________。
(4)实验验证氯的非金属性大于硫:A中放浓盐酸、B中放KMnO4、C中盛放__________(填写试剂名称),C中反应的离子方程式为____________________。从环境保护的观点考虑,此装置缺少尾气处理装置,可用____________溶液吸收尾气。
(5)若要证明非金属性:C>Si,则A中加盐酸、B中加Na2CO3、C中加__________,观察到C中溶液的现象为___________________________________。有同学认为盐酸具有挥发性,可进入C中干扰实验,应在两装置间添加装有____________溶液的洗气瓶。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com