
科目: 来源: 题型:
【题目】已知:NOx能与Na2O2反应;NO和NO2均能与酸性KMnO4溶液反应生成NO3ˉ和Mn2+。
I.用下图所示装置(略去夹持仪器)可制得少量亚硝酸钠(2NO+Na2O2=2NaNO2)。

(1)B、D的仪器名称是________,D的作用是________。
(2)通NO前,需先通一段时间N2,目的是________,
(3)E中主要反应的离子方程式为________,
(4)常温下,测得实验前后C的质量差值为0.30g,则制得NaNO2________g。
Ⅱ.NO2和Na2O2都有较强氧化性,为探究NO2与Na2O2反应的产物,提出如下假设:
假设i.NO2氧化Na2O2;假设ii.Na2O2氧化NO2。
甲同学设计如图所示实验装置:

请回答下列问题:
(5)单向阀在实现气体单向流通的同时,还有一个作用是___________。
(6)待试管G中收集满气体,向试管G中加入适量Na2O2粉末,塞紧塞子,轻轻振荡试管内粉末,观察到红棕色气体迅速消失;再将带火星的木条迅速伸进试管内,木条复燃,甲同学据此认为假设i正确。乙同学认为该装置不能达到实验目的,为达到实验目的,应在F、G之间增加一个M装置,M中应盛装__________(可供选择的试剂:碱石灰,浓硫酸饱和氯化钠溶液);乙同学用改进后的装置,重复了甲同学的实验操作,观察到红棕色气体迅速消失,带火星的木条未复燃。得到结论:假设ⅱ正确。
请做出正确判断,写出NO2和Na2O2反应的化学方程式__________
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A.反应TiO2(s) + 2Cl2(g)=TiCl4(g) + O2(g) ΔH>0能自发进行,其原因是ΔS>0
B.室温下,pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合,溶液pH>7
C.CH3COOH溶液加水稀释后,溶液中![]() 的值减小
的值减小
D.对于乙酸与乙醇的酯化反应(ΔH<0),加入少量浓硫酸并加热,该反应的反应速率和平衡常数均增大
查看答案和解析>>
科目: 来源: 题型:
【题目】![]() 物质结构与性质
物质结构与性质![]() VA族元素单质及其化合物在工农业生产中有重要用途。回答下列问题:
VA族元素单质及其化合物在工农业生产中有重要用途。回答下列问题:
![]() 基态As原子的核外电子排布式为
基态As原子的核外电子排布式为![]() ________,有________个未成对电子。
________,有________个未成对电子。
![]() 元素周期表中,与P紧邻的4种元素中电负性最大的是________(填元素符号
元素周期表中,与P紧邻的4种元素中电负性最大的是________(填元素符号![]() 。Si、P、S三种元素的第一电离能由大到小的顺序是________。
。Si、P、S三种元素的第一电离能由大到小的顺序是________。
![]() 铵盐大多不稳定,
铵盐大多不稳定,![]() F、
F、![]() 中,较易分解的是________,原因是________。
中,较易分解的是________,原因是________。
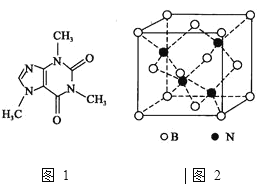
![]() 咖啡因对中枢神经有兴奋作用,其结构简式如图1。常温下,咖啡因在水中的溶解度为
咖啡因对中枢神经有兴奋作用,其结构简式如图1。常温下,咖啡因在水中的溶解度为![]() ,加适量水杨酸钠
,加适量水杨酸钠![]() 可使其溶解度增大,其原因可能是________,分子中氮原子的杂化类型有________。
可使其溶解度增大,其原因可能是________,分子中氮原子的杂化类型有________。
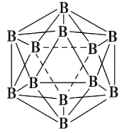
![]() 氮化硼、氮化铝、氮化镓的结构类似于金刚石,熔点如表中所示:
氮化硼、氮化铝、氮化镓的结构类似于金刚石,熔点如表中所示:
物质 | BN | AIN | GaN |
熔点 | 3000 | 2200 | 1700 |
![]() 试从结构的角度分析它们熔点不同的原因________。
试从结构的角度分析它们熔点不同的原因________。
![]() 的晶胞结构如图2所示,晶体中一个B原子周围距离最近的N原子有________个;若B、N的原子半径分别为
的晶胞结构如图2所示,晶体中一个B原子周围距离最近的N原子有________个;若B、N的原子半径分别为![]() 和
和![]() ,密度为
,密度为![]() ,阿伏加德罗常数值为
,阿伏加德罗常数值为![]() ,则BN晶胞中原子的体积占晶胞体积的百分率为________。
,则BN晶胞中原子的体积占晶胞体积的百分率为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述正确的是( )
A.金属钠着火时,可用泡沫灭火器灭火
B.常温下,Al、Fe遇浓硫酸或浓硝酸发生钝化
C.蔗糖与银氨溶液在水浴加热条件下可发生银镜反应
D.电解精炼铜过程中,若阳极质量减少32g,则电路中转移电子数目为![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】太阳能电池板材料除单晶硅外,还有氮、硼、硒、钛、钴、钙等元素组成的化学物质。
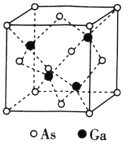
(1)钙原子基态时的电子排布式为___________,金属钴堆积方式与镁相似,都属于六方最密堆积,其配位数是___________。
(2)氮元素的第一电离能在同周期中(稀有气体除外)从大到小排第___________位;写出与NO3-互为等电子体的一种非极性分子的化学式___________。
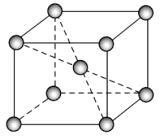
(3)晶体硼的结构单元是正二十面体,每个单元中有12个硼原子(如图),其中有两个原子为10B,其余为11B,则该结构单元有___________种不同的结构类型。已知硼酸(H3BO3)为一元弱酸,解释其为一元弱酸的原因____________________________________________。硼酸的结构与石墨相似,层内的分子以氢键相连,含lmol硼酸的晶体中有___________mol氢键。
(4)硒是动物体必需的营养元素。SeO2是硒的重要化合物,SeO2的价层电子对互斥模型是___________。
(5)在浓的TiCl3的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6,组成为TiCl3·6H2O的晶体,该晶体中两种配体的物质的量之比为1︰5,则该配离子的化学式为___________。
(6)钴晶体的一种晶胞是一种体心立方结构(如图所示),若该晶胞的边长为am,密度为ρg/cm3,NA表示阿伏加德罗常数的值,则钴的相对原子质量可表示为___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】一种新型钙钛矿太阳能电池具有较高的能量转化率,其组成有多种,主要由![]() 、
、![]() 、
、![]() 、
、![]() ,
,![]() 、
、![]() 、
、![]() 等离子中的某几种组成。
等离子中的某几种组成。
![]() 中运动在能量最高的能级上的电子自旋方向有_____种;氮与左右相邻的两种元素第一电离能由大到小的顺序为_______。
中运动在能量最高的能级上的电子自旋方向有_____种;氮与左右相邻的两种元素第一电离能由大到小的顺序为_______。
![]() 基态铁原子的核外电子排布式为________,铅元素的电子由________
基态铁原子的核外电子排布式为________,铅元素的电子由________![]() 填“激发态”或“基态”
填“激发态”或“基态”![]() 跃迁到另一状态时会产生绿色的焰色反应。
跃迁到另一状态时会产生绿色的焰色反应。
![]() 中碳原子的杂化轨道类型为_______,以N原子为中心的几个微粒的空间构型为_________,该离子中
中碳原子的杂化轨道类型为_______,以N原子为中心的几个微粒的空间构型为_________,该离子中![]() 键之间的键角________
键之间的键角________![]() 中
中![]() 间键角
间键角![]() 填“
填“![]() ”或“
”或“![]() ”
”![]() 。
。
![]() 常温下,
常温下,![]() 、
、![]() 、
、![]() 分别为气体、液体、固体。则
分别为气体、液体、固体。则![]() 的晶体类型为_________,从结构角度解释上述三种物质状态的变化:___________________________。
的晶体类型为_________,从结构角度解释上述三种物质状态的变化:___________________________。
![]() 某钙钛矿太阳能电池材料的晶胞如图所示,其晶胞参数为
某钙钛矿太阳能电池材料的晶胞如图所示,其晶胞参数为![]() 、密度为
、密度为![]() 。
。
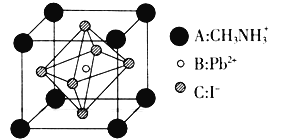
则该晶体中![]() _________,该晶体的摩尔质量
_________,该晶体的摩尔质量![]() _____
_____![]() 用含d、
用含d、![]() 等符号的式子表示,用
等符号的式子表示,用![]() 表示阿伏加德罗常数的值
表示阿伏加德罗常数的值![]() 。
。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学变化是有条件的。某小组同学探究I-与金属阳离子的氧化还原反应,实验过程如下。已知同浓度的稀溶液中氧化性:Ag+>Fe3+>Cu2+。
实狯 | 现象 | ||
| 编号 | 溶液x | |
I | 0.1mol/LFe(NO3)2,pH≈l | 溶液黄色立即加深,30秒后溶液变为褐色,无浑浊 | |
Ⅱ | KNO3和HNO3,其中c(NO3-)=0.3mol/L,pH≈1 | 1小时内溶液颜色始终保持无色 | |
Ⅲ | 0.1mol/LAgNO3 | 迅速变浑浊,离心分离后上层溶液为无色(经检测无I2),固体为黄色(AgI) | |
IV | 0.1mol/LCu(NO3)2 | 5秒后溶液由浅蓝色变为黄色并产生浑浊,离心分离后上层溶液为黄色(经检测有I2),固体为白色(CuI) | |
(1)根据实验I和Ⅱ,请回答下列问题。
①由“黄色立即加深”初步判断有I2生成,选择___(填试剂)进一步证实生成了I2。
②写出Fe3+与I-反应的离子方程式___,该条件下氧化性:Fe3+___I2(选填“>”或“<”)。
③实验Ⅱ的目的是___。
(2)实验Ⅳ中Cu2+与I-反应的离子方程式是___,甲同学得出氧化性:Cu2+>I2。
(3)乙同学认为甲同学的结论不合理,分析原因:实验Ⅲ应有I2生成,但却生成了AgI沉淀,因此推测实验Ⅳ中I2的生成,与CuI沉淀有关,故不能确定氧化性:Cu2+>I2,并用如图装置进行验证。K闭合后,较长时间发现两侧溶液均无明显变化。乙同学为了进一步判断Cu2+和I2的氧化性强弱,将左侧电极改为Cu电极,并向右侧溶液中加入少量___(填试剂),发现指针偏转,且左侧溶液颜色加深,证明该条件下氧化性:Cu2+___I2(选填“>”或“<”)。
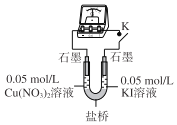
(4)该小组同学进一步分析认为,实验Ⅲ没有发生2Ag++2I-=2Ag+I2的反应,原因是生成AgI沉淀,反应物浓度迅速降低,不利于该反应进行;请分析实验Ⅳ发生氧化还原反应的原因是___。
(5)小组同学反思实验,反应体系中,各物质浓度对氧化还原反应是否发生都有一定的影响。
查看答案和解析>>
科目: 来源: 题型:
【题目】在![]() 的反应中,下列说法不正确的是
的反应中,下列说法不正确的是![]()
![]()
A.![]() 既是氧化剂,又是还原剂
既是氧化剂,又是还原剂
B.KCl是还原产物,![]() 是氧化产物
是氧化产物
C.反应中每消耗![]() ,转移电子数为
,转移电子数为![]()
D.该氧化还原反应中只有氯元素化合价发生了改变
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A.增大压强或升高温度,—定能使化学反应速率加快
B.合成氨工业中,将氨气液化分离来可以提高正反应速率和产率
C.500°C、30 MPa下,0.5 mol N2(g)和1.5mol H2(g)反应生成NH3(g) 放热QkJ,其热化学方程式为N2(g)+3 H2(g) ![]() 2 NH3(g) △H=-2QkJ/mol
2 NH3(g) △H=-2QkJ/mol
D.己知两个平衡体系:2NiO(s) ![]() 2Ni(s)+O2(g) 2CO(g)+O2(g)
2Ni(s)+O2(g) 2CO(g)+O2(g) ![]() 2CO2(g)是平衡常数分别为K1和K2,可推知平衡NiO(s)+CO(g)
2CO2(g)是平衡常数分别为K1和K2,可推知平衡NiO(s)+CO(g) ![]() Ni(s)+CO2(g)的平衡常数为
Ni(s)+CO2(g)的平衡常数为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com