
科目: 来源: 题型:
【题目】已知热化学方程式SO2(g)+1/2O2(g)![]() SO3(g) △H=-98.32kJ·mol-1,在容器中充入2mol SO2和1mol O2充分反应,最终放出的热量
SO3(g) △H=-98.32kJ·mol-1,在容器中充入2mol SO2和1mol O2充分反应,最终放出的热量
A. 等于196.64kJ B. 等于196.64kJ·mol-1
C. 小于196.64kJ D. 大于196.64kJ
查看答案和解析>>
科目: 来源: 题型:
【题目】化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的,如下图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化。则下列说法正确的是

A. 通常情况下,NO比N2稳定
B. 通常情况下,N2(g)和O2(g)混合能直接生成NO
C. 1molN2(g)和1molO2(g)具有的总能量小于2mol NO(g)具有的总能量
D. 1molN2(g)和1molO2(g)反应放出的能量为180kJ
查看答案和解析>>
科目: 来源: 题型:
【题目】氮是大气中含量最多的气体,研究氮及其化合物对人类有重要的意义。
(1)合成氨的原理为:N2(g)+3H2![]() 2NH3△H=-92.4kJ/mol
2NH3△H=-92.4kJ/mol
①将一定量的N2(g)和H2(g)放入1L的密闭容器中,在500℃、2×107Pa下达到平衡,平衡时测得N2为0.1 mol,H2为0.3 mol,NH3为0.1 mol。该条件下H2的转化率为______。
此温度下该反应的平衡常数K=__________。
②欲提高H2的转化率,下列措施可行的是___________。
a.向容器中按原比例再充入原料气
b.向容器中再充入惰性气体
c.改变反应的催化剂
d.液化生成物分离出氨
(2)在2L密闭容器中,800℃时反应2NO(g)+O2(g) ![]() 2NO2(g) △H<0体系中,各成分浓度随时间的变化如图:
2NO2(g) △H<0体系中,各成分浓度随时间的变化如图:
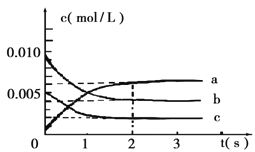
①用O2表示从0~2s内该反应的平均速率υ=___________。
②能说明该反应已经达到平衡状态的是_________。
a.υ(NO2)=2υ(O2)
b.容器内压强保持不变
c.υ逆(NO)=2υ正(O2)
d.容器内的密度保持不变
③为使该反应的反应速率增大,且平衡向正反应方向移动的是_________。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效的催化剂
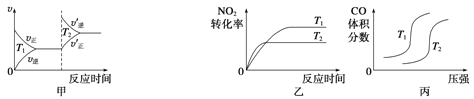
(3)汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气体。4CO(g)+2NO2(g)![]() 4CO2(g)+N2(g) ΔH=-1 200 kJ·mol-1对于该反应,温度不同(T2>T1)、其他条件相同时,下列图像正确的是______(填代号)。
4CO2(g)+N2(g) ΔH=-1 200 kJ·mol-1对于该反应,温度不同(T2>T1)、其他条件相同时,下列图像正确的是______(填代号)。
查看答案和解析>>
科目: 来源: 题型:
【题目】铁、铜等金属及其化合物在生产、生活中用途非常广泛。回答下列问题:
(1)![]() 可用作抗震剂,通过下列反应获得:
可用作抗震剂,通过下列反应获得:![]() 。
。
①基态![]() 原子核外电子排布式为________,其原子核外未成对电子数为________。
原子核外电子排布式为________,其原子核外未成对电子数为________。
②与CO具有相同空间构型和键合形式的阴离子是________(填化学式),CO分子中σ键与π键数目之比为________,C、N、O三种元素第一电离能由小到大的顺序为________。
(2)向含![]() 的溶液中滴加少量的
的溶液中滴加少量的![]() 溶液,溶液中生成红色的
溶液,溶液中生成红色的![]() ,中心离子
,中心离子![]() 的配位数为________,配体是________,
的配位数为________,配体是________,![]() 分子中O原子的杂化方式为________。
分子中O原子的杂化方式为________。
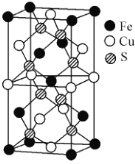
(3)一种含有Fe、Cu、S三种元素的化合物的晶胞如图所示(晶胞底面为正方形),该化合物的化学式为________,若晶胞的底面边长为![]() ,晶体的密度为
,晶体的密度为![]() ,阿伏加德罗常数为
,阿伏加德罗常数为![]() ,该晶胞的高为________
,该晶胞的高为________![]() 。
。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上制备纯硅反应的热化学方程式为SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g) ΔH=QkJ/mol(Q>0),某温度、压强下,将一定量反应物通入密闭容器中进行以上反应(此条件下为可逆反应),下列叙述正确的是( )
Si(s)+4HCl(g) ΔH=QkJ/mol(Q>0),某温度、压强下,将一定量反应物通入密闭容器中进行以上反应(此条件下为可逆反应),下列叙述正确的是( )
A.反应过程中,增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1mol,则达平衡时,吸收热量为QkJ
C.反应至4min时,若HCl的浓度为0.12mol/L,则H2的反应速率为0.03mol/(L·min)
D.当反应吸收热量为0.025QkJ时,生成的HCl通入100mL1mol/L的NaOH溶液中恰好完全反应
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室常用如下装置制备乙酸乙酯。下列有关分析不正确的是

A. b中导管不能插入液面下,否则会阻碍产物的导出
B. 固体酒精是一种白色凝胶状纯净物,常用于餐馆或野外就餐
C. 乙酸乙酯与![]() 互为同分异构体
互为同分异构体
D. 乙酸、水、乙醇羟基氢的活泼性依次减弱
查看答案和解析>>
科目: 来源: 题型:
【题目】分别进行下列操作,由现象得出的结论正确的是![]()
选项 | 操作 | 现象 | 结论 |
A | 滴加 | 生成白色沉淀 | 原溶液中一定有 |
B | 将某气体通入品红溶液中 | 品红溶液褪色 | 该气体一定是 |
C | 滴加少量稀NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无 |
D | 将钠放入滴有酚酞的水中 | 溶液变红 | 钠与水反应后的溶液显碱性 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】利用如图所示装置进行以下实验,能得到相应实验结论的是( )
选项 | ① | ② | ③ | 实验结论 |
|
A | 浓氨水 | NaOH | 酚酞 | NaOH 的碱性比 NH3·H2O 的强 | |
B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
C | 浓硫酸 | Cu | Na2S | SO2 具有氧化性 | |
D | 浓硝酸 | Na2CO3 | Na2SiO3 | 非金属性:N>C>Si |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,在体积为3L的密闭容器中化学反应CO(g)+2H2(g)![]() CH3OH(g)达到平衡状态。
CH3OH(g)达到平衡状态。
(1)该反应的平衡常数表达式K=__;根据图,升高温度,K值将__(填“增大”、“减小”或“不变”)。

(2)500℃时,从反应开始到化学平衡状态,以H2的浓度变化表示的化学反应速率是__(用nB、tB表示)。
(3)判断该可逆反应达到化学平衡状态的标志是__(填字母,下同)。
a.υ生成(CH3OH)=υ消耗(CO) b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变 d.CO、H2、CH3OH的浓度均不再变化
(4)300℃时,将容器的容积压缩到原来的![]() ,在其他条件不变的情况下,对平衡体系产生的影响是____。
,在其他条件不变的情况下,对平衡体系产生的影响是____。
a.c(H2)减小 b.正反应速率加快,逆反应速率减慢
c.CH3OH的物质的量增加 d.重新平衡时![]() 减小
减小
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:CH3CH2CH2CH2OH→CH3CH2CH2CHO
利用下图装置用正丁醇合成正丁醛。相关数据如下:
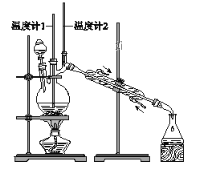
物质 | 沸点/℃ | 密度/(g·cm-3) | 水中溶解性 |
正丁醇 | 117.2 | 0.8109 | 微溶 |
正丁醛 | 75.7 | 0.8017 | 微溶 |
下列说法中,不正确的是( )
A. 为防止产物进一步氧化,应将酸化的Na2Cr2O7溶液逐滴加入正丁醇中
B. 向获得的粗正丁醛中加入少量金属钠,检验其中是否含有正丁醇
C. 反应结束,将馏出物倒入分液漏斗中,分去水层,粗正丁醛从分液漏斗上口倒出
D. 当温度计1示数为90~95℃,温度计2示数在76℃左右时,收集产物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com