
科目: 来源: 题型:
【题目】三氯氢硅(SiHCl3)是制备硅烷、多晶硅的重要原料。回答下列问题:
(1)SiHCl3在常温常压下为易挥发的无色透明液体,遇水气时发烟生成(HSiO)2O等,写出该反应的化学方程式___。
(2)SiHCl3在催化剂作用下发生反应:
2SiHCl3(g)=SiH2Cl2(g)+SiCl4(g) ΔH1=48kJ·mol-1
3SiH2Cl2(g)=SiH4(g)+2SiHCl3(g) ΔH2=-30kJ·mol-1
则反应4SiHCl3(g)=SiH4(g)+3SiCl4(g)的ΔH=___kJ·mol-1。
(3)对于反应2SiHCl3(g)=SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323K和343K时SiHCl3的转化率随时间变化的结果如图所示。
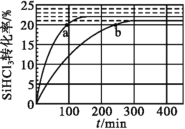
①343K时反应的平衡转化率α=___%。
②比较a、b处反应速率大小:va___vb(填“大于”“小于”或“等于”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】锰的合金及其化合物在现代生产、生活中有着广泛的应用。如二氧化锰是重要的氧化剂、催化剂、干电池中的去极剂;硫酸锰是重要的微量元素肥料。
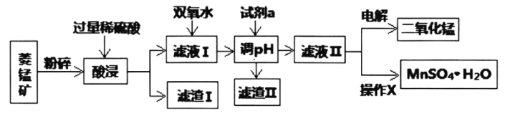
Ⅰ.某工厂以菱锰矿(MnCO3)[含FeCO3、SiO2、Cu2(OH)2CO3等杂质]为原料联合生产二氧化锰、硫酸锰晶体的工艺流程如下图所示:
常温下几种金属氧化物沉淀时的pH:
Mn(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀时的pH | 7.2 | 2.7 | 4.7 |
完全沉淀时的pH | x | 3.7 | 6.7 |
(1)该工厂调pH时,选择试剂a的成分最好是________,滤渣Ⅱ的成分是________,操作X是________、洗涤、低温烘干。
(2)为确保除尽杂质而又不损失锰,pH调整的范围为________;若常温下离子(X)沉淀完全的标准是c(X)<1.0×10-5mol/L,Ksp[Mn(OH)2]=1.0×10-13,则使Mn2+完全沉淀时溶液的pH最小为________。
(3)若滤液Ⅱ显酸性,请写出电解法制备MnO2时阳极上的电极反应式:________。
Ⅱ.50.7g MnSO4·H2O样品受热分解过程的热重曲线(样品质量随温度变化曲线)如下图所示。(已知:M(Mn)=55g/mol)
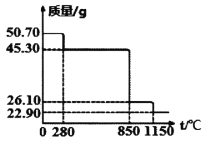
(1)850℃时,所得固体的化学式为:________________________。
(2)1150℃时,反应的化学方程式为:________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列叙述正确的是
A.标准状况下,22.4L CCl4含有的分子数为NA
B.2.4gMg溶于足量稀盐酸,转移的的电子数为0.1NA
C.通常状况下,32gO2与32gO3所含的氧原子数均为2NA
D.物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl-的数目为 NA
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法不正确的是( )
A.46 g C2H6O中含有的C-H键数一定为5NA
B.常温常压下,17g甲基(-14CH3)所含电子总数为9NA
C.标准状况下,11.2 L CO2和乙炔的混合气体所含![]() 键数目为NA
键数目为NA
D.CO2气体与足量的Na2O2反应,固体增重28g时转移了NA个电子
查看答案和解析>>
科目: 来源: 题型:
【题目】298K时,用0.1000mol/L NaOH溶液滴定20.00mL同浓度的甲酸溶液过程中溶液pH与NaOH溶液体积的关系如图所示(已知:HCOOH溶液的Ka=l.0×10-4.0)

下列有关叙述正确的是
A. 该滴定过程应该选择甲基橙作为指示剂
B. 图中a、b两点氷的电离程度:b>a
C. 当加入10.00mL NaOH溶液时,溶液中:c(HCOO)>c(H+)>c(Na+)>c(OH)
D. 当加入20.00mL NaOH溶液时,溶液pH>8.0
查看答案和解析>>
科目: 来源: 题型:
【题目】NA代表阿伏加德罗常数,下列说法正确的是
A.分子数为NA的CO、C2H4混合气体体积约为22.4 L,质量为28 g
B.已知2CO(g)+O2(g)![]() 2CO2(g);△H=-akJ﹒mol-1,将2NA个CO与NA个O2混合充分反应放出akJ的热量。
2CO2(g);△H=-akJ﹒mol-1,将2NA个CO与NA个O2混合充分反应放出akJ的热量。
C.用石灰乳完全吸收l mol Cl2时,转移电子的数目是NA
D.常温下,0.1mol/LNa2CO3溶液中,含有阴离子的总数大于0.1NA
查看答案和解析>>
科目: 来源: 题型:
【题目】已知某反应aA(g)+bB(g) cC(g)△H = Q 在密闭容器中进行,在不同温度(T1 和 T2 )及压强(P1 和 P2 )下,混合气体中 B 的质量分数 w(B)与反应时间(t)的关系如图所示,下列判断正确的是 ( )
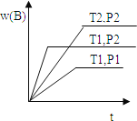
A.T1<T2,P1<P2,a+b>c,Q<0
B.T1>T2,P1<P2,a+b<c,Q>0
C.T1<T2,P1>P2,a+b<c,Q>0
D.T1>T2,P1>P2,a+b>c,Q<0
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:C(s)+CO2(g)![]() 2CO(g) △H>0。该反应达到平衡后,下列条件有利于反应向逆方向进行的是
2CO(g) △H>0。该反应达到平衡后,下列条件有利于反应向逆方向进行的是
A.升高温度和增大压强B.降低温度和减小压强
C.降低温度和增大压强D.升高温度和减小压强
查看答案和解析>>
科目: 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,22.4 L庚烷的分子数约为NA
B.1 L0.1mol/L的Na2S溶液中S2-和HS-的总数为0.1NA
C.4.0 g![]() 与D2O的混合物中所含中子数为2NA
与D2O的混合物中所含中子数为2NA
D.50 mL12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA
查看答案和解析>>
科目: 来源: 题型:
【题目】认真观察图中装置,回答下列问题:
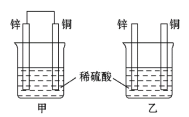
(1)下列说法中正确的是_________(填序号)。
a.甲中铜片质量减少 b.乙中锌片质量减少
c.乙中铜片上没有明显变化 d.甲装置为原电池,乙装置为电解池
(2)同等条件下,两烧杯中产生气泡的速率:甲______(填“>”“<”或“=”)乙。
(3)甲烧杯中锌电极为_______(正极或负极),写出铜极的反应电极方程式_______。
(4)当甲中产生2.24 L(标准状况)气体时,理论上通过导线的电子数目为_______mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com