
科目: 来源: 题型:
【题目】工业上常通过高温分解FeSO4的方法制备Fe2O3,为检验FeSO4高温分解的产物,并进行有关探究实验,回答下列问题:
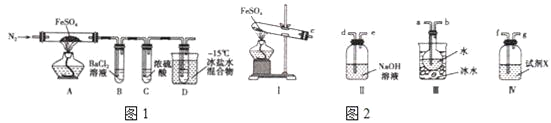
实验一:高温分解FeSO4,利用如图1所示的实验装置进行实验。
已知:①SO2熔点为-72℃,沸点为-10℃;②SO3熔点为-16.8℃,沸点为44.8℃。
(1)连接装置,检验气密性良好,放入药品,通入一段时间N2然后加热,通入N2的目的是___。
(2)隔绝空气加热至650℃,看到B中有白色沉淀,D试管中有无色液体,硬质玻璃管中的固体变为___,同时有两种无色气体生成,写出该反应的化学方程式___。
(3)反应完毕后,停止加热冷却后,取硬质玻璃管中固体,加盐酸,反应的离子方程式是___,将反应后所得溶液滴入D试管中,溶液变为浅绿色,该反应的离子方程式是___。
实验二:探究高温分解FeSO4生成的气体
(4)用如图2所示装置设计实验,验证高温分解FeSO4生成的气态物质
①按气流方向连接各仪器,用字母表示接口的连接顺序:c-___。
②试剂X的名称是___。
③充分反应后,利用装置 III中圆底烧瓶内混合物测定已分解的FeSO4的质量,向圆底烧瓶中逐渐滴入氯化钡溶液,直到沉淀完全;然后过滤混合物,在过滤器上将沉淀洗净后,烘干并冷却至室温,称重.若最终得到沉淀的质量为Wg,则已分解的FeSO4的质量__g。
查看答案和解析>>
科目: 来源: 题型:
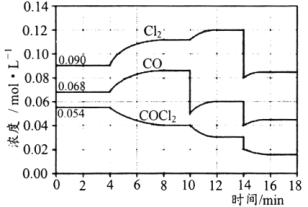
【题目】T℃时,在密闭容器中进行的反应:COCl2(g)CO(g)+Cl2(g)△H=108kJ·mol-1,在4min、10min、14min时均只改变影响平衡的一个条件,各物质的浓度变化如图所示:
下列说法正确的是( )
A.4min时改变的条件是:降低体系的温度
B.10min时改变的条件是:向体系中再充入Cl2
C.14min时改变的条件是:增大容器的体积
D.若T℃时,起始向2L的恒容密闭容器中充入COCl2、Cl2、CO均为0.20mol,则达到平衡前,v正>v逆
查看答案和解析>>
科目: 来源: 题型:
【题目】肼(N2H4)为二元弱碱,在水中的电离方式与NH3相似。25℃时,水合肼(N2H4·H2O)的电离常数K1、K2依次为9.55×10-7、1.26×10-15。下列推测或叙述一定错误的是
A.N2H4易溶于水和乙醇
B.N2H4分子中所有原子处于同一平面
C.N2H6Cl2溶液中:2c(N2H![]() )+c(N2H
)+c(N2H![]() )>c(Cl-)+c(OH-)
)>c(Cl-)+c(OH-)
D.25°C时,反应H++N2H4N2H![]() 的平衡常数K=9.55×107
的平衡常数K=9.55×107
查看答案和解析>>
科目: 来源: 题型:
【题目】燃料乙醇的生产过程示意图如图所示:
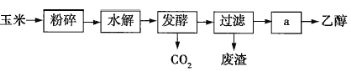
(1)粉碎玉米的目的是__________________________________。
(2)玉米中所含有机物的主要成分是________(填名称)。
(3)步骤a的操作是________(填名称)。
A.蒸发 B.萃取 C.蒸馏 D.分液
(4)发酵产生的![]() 的纯度可达99%,可回收利用,请列举出它的两种用途: ________________________。
的纯度可达99%,可回收利用,请列举出它的两种用途: ________________________。
(5)用葡萄糖制乙醇的化学方程式可表示为![]() 。根据上述反应式,可计算出100kg淀粉在理论上生产的无水乙醇为________kg。
。根据上述反应式,可计算出100kg淀粉在理论上生产的无水乙醇为________kg。
查看答案和解析>>
科目: 来源: 题型:
【题目】通过以下反应可获得新型能源二甲醚(![]() )。下列说法不正确的是
)。下列说法不正确的是
①![]()
![]()
②![]()
![]()
③![]()
![]()
④![]()
![]()
A. 反应①、②为反应③提供原料气
B. 反应③也是![]() 资源化利用的方法之一
资源化利用的方法之一
C. 反应![]() 的
的![]()
D. 反应![]() 的
的![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】下列表示对应化学反应的离子方程式正确的是
A.氯气溶于水:Cl2+H2O![]() H++Cl-+HClO
H++Cl-+HClO
B.MnO2与浓盐酸反应制Cl2:MnO2+4HCl![]() Mn2++2Cl-+Cl2↑+2H2O
Mn2++2Cl-+Cl2↑+2H2O
C.Na2O2溶于水产生O2:Na2O2+H2O=2Na++2OH-+O2↑
D.向NaHCO3溶液中加过量澄清石灰水:2HCO+Ca2++2OH-=CaCO3↓+CO![]() +2H2O
+2H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】高锰酸钾是锰的重要化合物和常用的氧化剂。以下是工业上用软锰矿制备高锰酸钾的一种工艺流程。
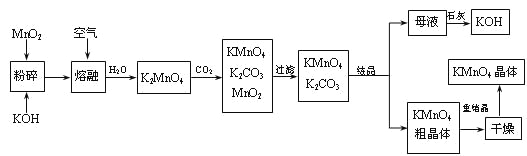
(1)KMnO4稀溶液是一种常用的消毒剂。其消毒机理与下列___(填序号)物质相似。
A.75%酒精 B.双氧水 C.苯酚 D.84消毒液(NaClO溶液)
(2)写出MnO2、KOH的熔融混合物中通入空气时发生的主要反应的化学方程式:
___________________________________________________________________。
(3)向K2MnO4溶液中通入CO2以制备KMnO4,该反应中的还原剂是:_______。
(4)上述流程中可以循环使用的物质有石灰、二氧化碳、___和___(写化学式)。
(5)若不考虑物质循环与制备过程中的损失,则1 mol MnO2可制得_____mol KMnO4。
查看答案和解析>>
科目: 来源: 题型:
【题目】碱式碳酸铜是一种用途广泛的化工原料,其化学式一般可表示为Cu(OH)2xCuCO3。某实验小组设计如下几个实验方案,测定碱式碳酸铜的组成,完成下列填空。
[方案一]用如图实验装置进行实验(夹持仪器省略),先通一段时间氮气,然后加热,加热完毕,再通一段时间氮气。
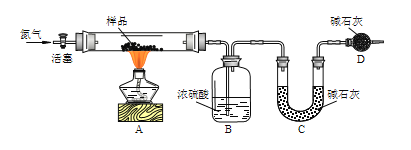
加热完毕再通一段时间氮气的作用是___。
若实验取14.200g样品,B装置增重0.900g,C装置增重3.300g,则x=___。
[方案二]用如图装置测定碱式碳酸铜与足量稀硫酸反应生成CO2的体积。
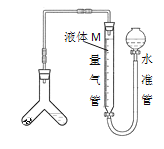
为了减小实验误差,量气管中液体M的选择原则是___。
通过实验,测得该试样中x值偏低,产生这种现象的原因可能是___
a.CO2气体中含有水蒸气
b.测定气体体积时未冷却至室温
c.Y型管中留有反应生成的气体
d.测定气体体积时水准管的液面高于量气管的液面
[方案三]该小组同学又用如下方案测定碱式碳酸铜的组成。
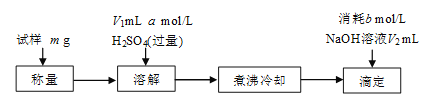
煮沸的目的主要是___。
若滴定时NaOH加入过量,则x值___(填“偏大”、“偏小”或“不变”)
查看答案和解析>>
科目: 来源: 题型:
【题目】抗癌化合物ethuliacoumarionA的结构简式如图所示。下列关于ethuliacoumarionA的说法正确的是
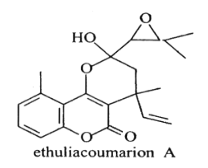
A.分子中有3种含氧官能团
B.分子中有4个手性碳原子
C.能发生银镜反应
D.1mol该化合物与NaOH溶液反应时至多消耗1molNaOH
查看答案和解析>>
科目: 来源: 题型:
【题目】某学习小组探究Mg与NaHCO3溶液反应的机理,做了如下探究。
实验一:
实验A | 实验B | |
操作 | 在注射器中加入过量镁片(擦去表面氧化膜),吸入15mL饱和NaHCO3溶液。 | 在注射器中加入过量镁片(擦去表面氧化膜),吸入15mL蒸馏水。 |
现象 | 有气体产生,20min后注射器内壁和底部产生大量白色沉淀 | 缓慢产生气体 |
(1)实验B的目的是___。
实验二:
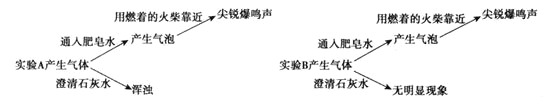
(2)根据实验二,实验A中产生的气体是___。(填分子式)
实验三:分别取少量实验A和B的上层清液于两支试管中,各加入2滴BaCl2溶液,A中立即产生白色沉淀,B中无明显现象。
(3)实验三说明Mg与NaHCO3溶液反应产生了___(填离子符号)。
实验四:该小组同学对实验A中产生的白色沉淀做出如下猜测:并用图所示装置进行实验,进一步确定白色沉淀的成分。

猜测1:白色不溶物可能为Mg(OH)2
猜测2:白色不溶物可能为MgCO3
猜测3:白色不溶物可能为碱式碳酸镁[yMg(OH)2xMgCO3]
(4)若用装置A、B组合进行实验,B中有白色浑浊,则猜想___不正确;将装置按A、C、B的顺序组合进行实验,当出现___现象时,猜想3是正确的。
实验五:用图所示装置测定碱式碳酸镁[yMg(OH)2xMgCO3]的组成:
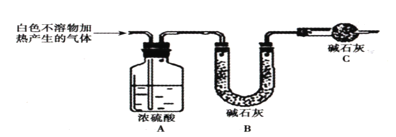
(5)称取干燥、纯净的白色不溶物7.36g,充分加热至不再产生气体为止,并使分解产生的气体全部进入装置A和B中。实验后装置A增重0.72g,装置B增重2.64g。装置C的作用是___,白色不溶物的化学式为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com