
科目: 来源: 题型:
【题目】化合物I(C11H12O3)是制备液晶材料的中间体之一,其分子中含有醛基和酯基。I可以用E和H在一定条件下合成:

已知以下信息:① A的核磁共振氢谱表明其只有一种化学环境的氢;
②R—CH=CH2![]() R—CH2CH2OH;③化合物F苯环上的一氯代物只有两种;④通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基。
R—CH2CH2OH;③化合物F苯环上的一氯代物只有两种;④通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基。
请回答下列问题:
(1)A的化学名称为______________。
(2)D的结构简式为_____________。
(3)E的分子式为_________________。
(4)F生成G的化学方程式为________________________,该反应类型为__________。
(5)I的结构筒式为____________。
(6)I的同系物J比I相对分子质量小14,J的同分异构体中能同时满足如下条件:
①苯环上只有两个取代基,②既能发生银镜反应,又能与饱和NaHCO3溶液反应放出CO2,符合以上条件的同分异构体共有___________种。
J的一种同分异构体发生银镜反应并酸化后核磁共振氢谱为三组峰,且峰面积比为2:2:1,写出J的这种同分异构体的结构简式________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】2019年,我国科学家研发出一种新型的锌碘单液流电池,已知M为阴离子交换膜,其原理如图所示。下列说法不正确的是
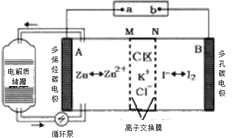
A.放电时A电极反应式为:Zn-2e﹣= Zn2+
B.充电时,B极与外接电源正极相连
C.放电时电解质储罐中离子浓度增大
D.放电时当A极减少65g时,C区Cl﹣增加2NA
查看答案和解析>>
科目: 来源: 题型:
【题目】下列表述正确的是
A.钢铁吸氧腐蚀中的正极反应:4OH 4e-=2H2O +O2↑
B.工业上用电解法制镁:MgCl2(熔融)![]() Mg+Cl2↑
Mg+Cl2↑
C.使pH试纸显蓝色的溶液中:Na+、Mg2+、ClO-、HSO3-能大量共存
D.![]() =0.1 mol·L-1的溶液中:Na+、HCO3-、K+、NO3-能大量共存
=0.1 mol·L-1的溶液中:Na+、HCO3-、K+、NO3-能大量共存
查看答案和解析>>
科目: 来源: 题型:
【题目】前四周期元素A、B、C、D、E、F的原子序数依次增大。A元素的基态阴离子的电子排布式与基态锂离子的相同,A和E位于同主族,基态B原子核外有3个能级且各能级上容纳的电子数相等,基态D原子核外有2个未成对电子,最外能层符号为L。+1价F离子的3d能级达到全充满结构。
回答下列问题:
(1)基态C原子价电子排布图为_________。
(2)B、C、D三种元素第一电离能由大到小排序为____(填元素符号,下同),它们的电负性由小到大排序为____。
(3)标准状况下,a L C2气体含π键的物质的量为__。与C2D互为等电子体的分子有___(任写一种)。B、C分别与D构成的阴离子中,立体构型为平面三角形的有___(填离子符号)。
(4)由A、B、C、D中的几种原子构成的分子中,含极性键的非极性分子有___(填一种,下同);既含极性键,又含非极性键的极性分子有___。
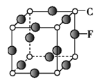
(5)C、F组成的晶体的晶胞如图所示。已知该晶体密度为ρ g·cm-3,NA代表阿伏加德罗常数的值,则C、F最近的核间距为____ pm。
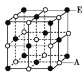
(6)A和E组成晶体,其晶胞如图所示。E粒子周围有___个E紧密相邻且最近;连接与E粒子等距离且最近的A粒子构成的形状是_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:C(s)的燃烧热△H = —393.5kJ·mol—1,C(s)+ ![]() O2 (g) = CO(g) △H = —110.5kJ·mol—1。测得某次实验中m g炭粉燃烧所得气体中,CO 和 CO2的体积比为1:2,则与这些炭完全燃烧(只生成CO2)相比较,损失的能量是
O2 (g) = CO(g) △H = —110.5kJ·mol—1。测得某次实验中m g炭粉燃烧所得气体中,CO 和 CO2的体积比为1:2,则与这些炭完全燃烧(只生成CO2)相比较,损失的能量是
A.![]() kJB.
kJB.![]() kJC.
kJC.![]() kJD.
kJD.![]() kJ
kJ
查看答案和解析>>
科目: 来源: 题型:
【题目】[化学—选修3:物质结构与性质]
前四周期原子序数依次增大的元素A,B,C,D中,A和B的价电子层中未成对电子均只有1个,平且A-和B+的电子相差为8;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2。
回答下列问题:
(1)D2+的价层电子排布图为_______。
(2)四种元素中第一电离最小的是________,电负性最大的是________。(填元素符号)
(3)A、B和D三种元素责成的一个化合物的晶胞如图所示。
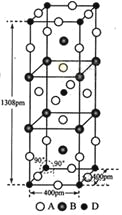
①该化合物的化学式为_________________;D的配位数为___________;
②列式计算该晶体的密度_______g·cm-3。
(4)A-、B+和C3+三种离子组成的化合物B3CA6,其中化学键的类型有_____________;该化合物中存在一个复杂离子,该离子的化学式为_______________,配位体是____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】保险粉(Na2S2O4)广泛应用于造纸、印染、环保、医药等行业。该物质具有强还原性,在空气中易被氧化,受热易分解,在碱性条件下比较稳定,易溶于水、不溶于乙醇。保险粉可以通过 NaHSO3与NaBH4反应制取。请按要求回答下列问题:
I.NaHSO3溶液的制备
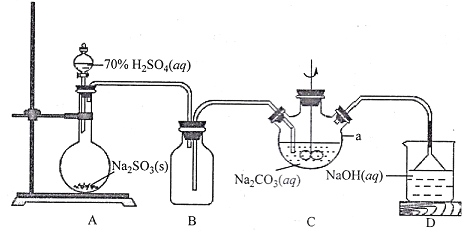
(1)上图仪器a的名称___________;装置C中反应后溶液pH=4.1,则发生反应的化学方程式为___________。
II.保险粉的制备
打开下图(部分装置已省略)中活塞K1通入氮气,一段时间后,关闭K1,打开恒压滴液漏斗活塞向装置E中滴入碱性NaBH4溶液,在30-40℃下充分反应。向反应后的溶液中加入乙醇,经冷却结晶、过滤得到Na2S2O4·2H2O晶体,再用乙醇洗涤、真空烘干脱去晶体结晶水得到保险粉。
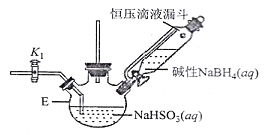
(2)反应产物中有NaBO2,无气体。写出E中发生反应的化学方程式___________。
(3)通入氮气的作用是______________________。
(4)使用乙醇洗涤Na2S2O4·2H2O晶体的优点:______________________。
(5)对装置E的加热方式最好采用______________________。
Ⅲ.保险粉的纯度测定
(6)称取2.0g Na2S2O4样品溶于冷水配成200mL溶液,取出25.00mL该溶液于锥形瓶中,用0.10mol/L碱性K3[Fe(CN)6]标准溶液滴定,原理为:4[Fe(CN)6]3-+2S2O42-+8OH-=4[Fe(CN)6]4-+4SO32-+4H2O,用亚甲基蓝为指示剂,达到滴定终点时消耗标准溶液24.00mL,则样品中Na2S2O4的质量分数为___________(杂质不参与反应)(计算结果精确至0.1%)。
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.12 g 金刚石中含有的共用电子对数为NA
B.1 mol AlCl3在熔融时离子总数为0.4NA
C.0.2 mol MnO2与足量浓盐酸反应转移的电子数小于 0.4NA
D.1 L 0.1 mol·Lˉ1 Na2CO3溶液中含有阴离子数大于 0.1 NA
查看答案和解析>>
科目: 来源: 题型:
【题目】下列热化学方程式中,△H 能正确表示对应物质的燃烧热的是
A.CO2 (g)=CO(g)+![]() O2(g) △H=+283.0kJ·mol-1
O2(g) △H=+283.0kJ·mol-1
B.S(s)+![]() O2(g)=SO3(g) △H=-396kJ·mol-1
O2(g)=SO3(g) △H=-396kJ·mol-1
C.H2(g)+![]() O2(g)=H2O(g) △H=-241.8kJ·mol-1
O2(g)=H2O(g) △H=-241.8kJ·mol-1
D.CH4(g)+2O2(g) = CO2(g)+2H2O(l) △H =—890.3kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】举世闻名的侯氏制碱法的工艺流程如下图所示,下列说法正确的是( )
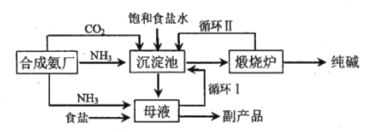
A.往母液中加入食盐的主要目的是使![]() 更多的析出
更多的析出
B.从母液中经过循环Ⅰ进入沉淀池的主要是![]() 、
、![]() 和氨水
和氨水
C.沉淀池中反应的化学方程式:![]()
D.设计循环Ⅱ的目的是使原料氯化钠的利用率大大提升
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com