
科目: 来源: 题型:
【题目】在容积为2.0 L的密闭容器内,物质D在T ℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图,下列叙述不正确的是
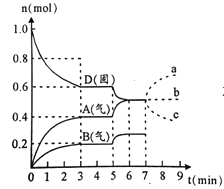
A. 从反应开始到第一次达到平衡时,A物质的平均反应速率为0.0667 mol/(L·min)
B. 该反应的化学方程式为2D(s) 2A(g)+B(g),该反应的平衡常数表达式为K=c(A)2·c(B)
C. 已知:反应的H>0,则第5分钟时图象呈现上述变化的原因可能是升高体系的温度
D. 若在第7分钟时增加D的物质的量,则表示A的物质的量变化正确的是a曲线
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)氯酸钾熔化,粒子间克服了__的作用力;二氧化硅熔化,粒子间克服了__的作用力;碘的升华,粒子间克服了__的作用力.三种晶体的熔点由高到低的顺序是__.
(2)下列六种晶体:①CO2,②NaCl,③Na,④Si,⑤CS2,⑥金刚石,它们的熔点从低到高的顺序为__(填序号).
(3)在H2、(NH4)2SO4、SiC、CO2、HF中,由极性键形成的非极性分子有__,由非极性键形成的非极性分子有__,能形成分子晶体的物质是__,含有氢键的晶体的化学式是__,属于离子晶体的是__,属于原子晶体的是__,五种物质的熔点由高到低的顺序是__.
(4)A,B,C,D为四种晶体,性质如下:
A.固态时能导电,能溶于盐酸
B.能溶于CS2,不溶于水
C.固态时不导电,液态时能导电,可溶于水
D.固态、液态时均不导电,熔点为3 500℃
试推断它们的晶体类型:A.__;B.__;C.__;D.__.
(5)图中A~D是中学化学教科书上常见的几种晶体结构模型,请填写相应物质的名称:
A.__;B.__;C.__;D.__.
查看答案和解析>>
科目: 来源: 题型:
【题目】MnSO4是制备高纯MnCO3的中间原料。实验室用如图所示装置可制备少量MnSO4溶液,反应原理为MnO2+H2SO3=MnSO4+H2O。下列说法错误的是( )
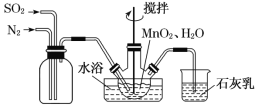
A. 若实验中将N2换成空气,则反应液中 的浓度之比变大
的浓度之比变大
B. 缓慢通入混合气体可提高SO2的转化率
C. 若不通N2,则烧瓶中的进气管口容易被堵塞
D. 石灰乳对尾气的吸收效果比澄清石灰水更好
查看答案和解析>>
科目: 来源: 题型:
【题目】SO2经一系列反应可以得到硫酸和芒硝(Na2SO4·10H2O),其转化关系如图:

(1)SO2可用于H2SO4。已知25℃、101kPa 时:
2SO2(g)+O2(g)+2H2O(l) = 2H2SO4(l) ΔH1=-456kJ/mol
SO3(g)+H2O(l)=H2SO4(l) ΔH2=-130kJ/mol
则I中SO2(g)→SO3(g)的热化学方程式是_____。
(2)若Ⅲ中将SO2通入NaHCO3溶液中,反应的离子反应方程式是_____。已知:25℃时,H2CO3电离平衡常数:K1=4.3×10-7K2=5.6×10-11;H2SO3电离平衡常数:K1=1.5×10-2K2=6.0×10-8
(3)若Ⅲ中将SO2通入NaOH 溶液中,得到NaHSO3溶液,用化学用语表示NaHSO3在水溶液中存在的可逆过程_____。25℃时,SO2与NaOH溶液反应后的溶液中,含硫各微粒(H2SO3、![]() 和
和![]() )的物质的量分数 X(i)与溶液 pH 的关系如图所示,下列说法不正确的是_____(填字母)。
)的物质的量分数 X(i)与溶液 pH 的关系如图所示,下列说法不正确的是_____(填字母)。

A.为获得更多的NaHSO3,应将溶液的 pH 控制在 4~5
B.pH=3 时,溶液中 c(![]() )>c(H2SO3)> c(
)>c(H2SO3)> c(![]() )
)
C.由 M 点坐标,可以计算H2SO3H++![]() 的电离常数
的电离常数
D.pH=9 时,溶液中存在c(H+)=c(![]() )+2c(
)+2c(![]() )+c(OH-)
)+c(OH-)
(4)通过电解法可分离NaHSO3与Na2SO3混合物,如图所示,结合化学用语解释 c 室只排出Na2SO3的原因_____。

(5)步骤 IV 中可以将NaHSO3转化为Na2SO4的试剂是_____,_____(任意写两种)。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知汽车尾气无害化处理反应为2NO(g)+2CO(g) ![]() N2(g)+2CO2(g)。下列说法正确的是
N2(g)+2CO2(g)。下列说法正确的是
A.升高温度可使该反应的逆反应速率降低
B.达到化学平衡时,化学反应已经停止
C.v正(NO)=v正(CO2)时,说明达到了化学平衡
D.单位时间内消耗CO和CO2的物质的量相等时,反应达到平衡
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增大。其中X与Y可形成一种淡黄色物质P,常温下将0.05 mol P溶于水,配成1 L溶液,其中![]() ;Z为金属元素,且Z可在W的一种氧化物中燃烧,生成一种白色的物质和一种黑色的物质。下列说法错误的是()
;Z为金属元素,且Z可在W的一种氧化物中燃烧,生成一种白色的物质和一种黑色的物质。下列说法错误的是()
A. 氢化物的沸点:W<X
B. 简单离子半径:X>Y>Z
C. 化合物P中既含有离子键又含有共价键
D. W、X、Y三种元素形成的物质的水溶液显碱性
查看答案和解析>>
科目: 来源: 题型:
【题目】最新合成的某有机物A的结构简式如图,它含有1个手性碳原子,具有光学活性。若要使A通过反应失去光学活性,则发生的反应类型不可能是( )

A. 酯化反应 B. 水解反应 C. 银镜反应 D. 加成反应
查看答案和解析>>
科目: 来源: 题型:
【题目】为比较Fe3+和Cu2+对H2O2分解反应的催化效果,甲、乙两位同学分别设计了如图甲、乙所示的实验。下列叙述中不正确的是( )

A.图甲所示实验可通过观察产生气泡的快慢来比较反应速率的大小
B.若图甲所示实验中反应速率为①>②,则一定说明Fe3+比Cu2+对H2O2分解催化效果好
C.用图乙装置测定反应速率,可测定反应产生的气体体积及反应时间
D.为检查图乙所示装置的气密性,可关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位
查看答案和解析>>
科目: 来源: 题型:
【题目】不同温度下,水溶液中![]() 的物质的量浓度和
的物质的量浓度和![]() 的物质的量浓度的关系如图所示.下列说法不正确的是
的物质的量浓度的关系如图所示.下列说法不正确的是![]()

A.M点和N点对应的溶液均呈中性
B.![]() 时,P点对应溶液中,水电离出来的
时,P点对应溶液中,水电离出来的![]() 可能为
可能为![]() 或
或![]()
C.![]() 时,
时,![]() 的NaOH溶液与
的NaOH溶液与![]() 的稀
的稀![]() 等体积混合,所得溶液的
等体积混合,所得溶液的![]()
D.向某溶液中加入酸或碱,均可以使该溶液从M点转化为N点
查看答案和解析>>
科目: 来源: 题型:
【题目】海水是一个巨大的化学资源宝库。

(1)海水中制得的氯化钠可用于生产烧碱及氯气,装置如图所示,下列说法正确的是____(填字母)。

A.阴极反应式是:Na++e-=Na
B.可以用铁做阴极,石墨做阳极
C.烧碱和氯气都在阳极生成
D.离子交换膜是阴离子交换膜(只允许阴离子通过)
(2)苦卤的主要成分是 MgCl2,此外还含 Fe2+、Fe3+、Al3+等离子。已知:生成氢氧化物沉淀的 pH
氢氧化物 | 开始沉淀 | 沉淀完全 |
Fe(OH)3 | 2.7 | 3.7 |
Fe(OH)2 | 7.6 | 9.6 |
Al(OH)3 | 3.7 | 4.7 |
Mg(OH)2 | 9.6 | 11.1 |
① 步骤 i 中加入 NaClO 的作用是_____,_____。
② 步骤 ii 需在 HCl 保护气中加热进行,HCl 保护气的作用是_____。
③ 若向苦卤中加入石灰乳,可以得到 Mg(OH)2沉淀,用化学平衡移动原理解释该反应过程_____。
(3)海水淡化前需对海水进行预处理。用如图所示 NaClO 的发生装置对海水进行消毒和灭藻处理。

① 装置中由NaCl 转化为NaClO 的离子方程式是_____,_____。
② 定量测定排出的海水中 Cl2 和 ClO-的含量。已知:2![]() +I2 =
+I2 =![]() +2I-。取 25.00 mL 排出的海水,加入过量 KI 溶液,然后用 a mol/LNa2S2O3 溶液滴定生成的 I2,达滴定终点时消耗Na2S2O3 溶液 b mL。该滴定操作选择的指示剂是_____,通过计算可知排出的 海水中 Cl2 和 ClO-的总物质的量浓度是_____mol/L。
+2I-。取 25.00 mL 排出的海水,加入过量 KI 溶液,然后用 a mol/LNa2S2O3 溶液滴定生成的 I2,达滴定终点时消耗Na2S2O3 溶液 b mL。该滴定操作选择的指示剂是_____,通过计算可知排出的 海水中 Cl2 和 ClO-的总物质的量浓度是_____mol/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com