
科目: 来源: 题型:
【题目】研究光盘金属层含有的Ag(其它金属微量忽略不计)、丢弃电池中的Ag2O等废旧资源的回收利用意义重大。下图为从光盘中提取Ag的工业流程。请回答下列问题。

(1)NaClO溶液在受热或酸性条件下易分解,“氧化”阶段需在80℃条件下进行,适宜的加热方式为________。
(2)NaClO溶液与Ag反应的产物为AgCl、NaOH和O2,该反应的化学方程式为________。有人提出以HNO3代替NaClO氧化Ag,从反应产物的角度分析,其缺点是________。
(3)操作Ⅰ的名称为____,简述利用“操作Ⅰ”的装置洗涤难溶物的实验操作________。
(4)化学上常用10%的氨水溶解AgCl固体,AgCl与NH3·H2O按1︰2反应可生成Cl-和一种阳离子________的溶液(填阳离子的化学式)。实际反应中,即使氨水过量也不能将AgCl固体全部溶解,可能的原因是________。
(5)常温时N2H4·H2O(水合肼)在碱性条件下能还原(4)中生成的阳离子,自身转化为无害气体N2,理论上消耗0.1 mol的水合肼可提取到________g的单质Ag。
(6)废旧电池中Ag2O能将有毒气体甲醛(HCHO)氧化成CO2,科学家据此原理将上述过程设计为原电池回收电极材料Ag并有效去除毒气甲醛。则此电池的正极反应式为________,负极的产物有________。
查看答案和解析>>
科目: 来源: 题型:
【题目】石油裂化和裂解过程得到的CH2=CH2,在一定条件下可以聚合成高分子化合物。含有 结构的化合物与CH2=CH2一样,可以在一定条件下聚合成高分子化合物。
结构的化合物与CH2=CH2一样,可以在一定条件下聚合成高分子化合物。
(1)广泛用作农用薄膜的聚氯乙烯塑料,是由CH2=CHCl在催化剂、加热的条件下聚合成的,其化学方程式是________________。
(2)电器包装中大量使用的泡沫塑料的主要成分是聚苯乙烯( ),它是由________________(写结构简式)聚合而成的。
),它是由________________(写结构简式)聚合而成的。
(3)CH2=CHCl与聚苯乙烯的单体在一定条件下可发生加聚反应,所得产物的结构简式为________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验:①0.005mol·L-1FeCl3溶液和0.015mol·L-1KSCN溶液各1mL混合得到红色溶液a,均分溶液a置于b、c两支试管中;
②向b中滴加3滴饱和FeCl3溶液,溶液颜色加深;
③再向上述b溶液中滴加3滴1mol·L-1NaOH溶液,溶液颜色变浅且出现浑浊;
④向c中逐渐滴加1mol·L-1KSCN溶液2mL,溶液颜色先变深后变浅。下列分析不正确的是( )
A.实验②中增大Fe3+浓度使平衡Fe3++3SCN-![]() Fe(SCN)3正向移动
Fe(SCN)3正向移动
B.实验③中有Fe(OH)3生成
C.实验③和④中溶液颜色变浅的原因相同
D.实验②、③、④均可说明浓度改变对平衡移动的影响
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)从含碘的有机溶液中提取碘和回收有机溶剂需要经过蒸馏操作,指出下图蒸馏装置中的错误之处并改正。

①____________________________________;
②____________________________________;
③____________________________________。
(2)上述有机溶剂为CC14(沸点为76. 8 ℃),进行上述蒸馏操作时,使用水浴加热的目的是________,最后晶体碘在______________中聚集。
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度时,在 5 L 的容器中,X、Y、Z 三种气体的物质的量随时间的变化曲线如图所示。请通过计算回答下列问题。
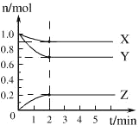
(1)反应进行至_________min 时达到平衡状态,此时 Y 的平均反应速率是________mol/ (L·min)。
(2)分析有关数据,写出 X、Y、Z 的反应方程式_________________;
(3)对于一个未知反应,影响反应速率的因素很多,请写出可能影响化学反应速率的三个因素:______________,____________,__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某磁黄铁矿的主要成分是FexS(S为-2价),既含有Fe2+又含有Fe3+。将一定量的该磁黄铁矿与100 mL的盐酸恰好完全反应(注:矿石中其他成分不与盐酸反应),生成2.4 g硫单质、0.425 mol FeCl2和一定量H2S气体,且溶液中无Fe3+。则下列说法正确的是 ( )
A. 100 mL的盐酸中HCl的物质的量浓度为7.5 mol·L-1
B. 生成的H2S气体在标准状况下的体积为2.24 L
C. 该磁黄铁矿FexS中,x=0.85
D. 该磁黄铁矿FexS中,Fe2+与Fe3+的物质的量之比为3∶1
查看答案和解析>>
科目: 来源: 题型:
【题目】![]() 在工业生产和日常生活中有重要用途。
在工业生产和日常生活中有重要用途。
I.工业上用钛矿石![]() ,含FeO、
,含FeO、![]() 、
、![]() 等杂质
等杂质![]() 经过下述反应制得:
经过下述反应制得:

其中,步骤![]() 发生的反应为:
发生的反应为:![]() 。
。
![]() 净化钛矿石时,是否需要除去杂质FeO?答: ______
净化钛矿石时,是否需要除去杂质FeO?答: ______ ![]() 填“需要”或“不需要”
填“需要”或“不需要”![]() 。
。
![]() 净化钛矿石时,需用浓氢氧化钠溶液来处理,写出该过程中发生反应的化学方程式: ______; ______。
净化钛矿石时,需用浓氢氧化钠溶液来处理,写出该过程中发生反应的化学方程式: ______; ______。
![]() 可通过下述两种方法制备金属钛:
可通过下述两种方法制备金属钛:
“方法一”是电解![]() 来获得Ti:将处理过的
来获得Ti:将处理过的![]() 作阴极,石墨为阳极,熔融CaO为电解液,用碳块作电解槽池。
作阴极,石墨为阳极,熔融CaO为电解液,用碳块作电解槽池。
![]() 阴极反应的电极反应式为 ______。
阴极反应的电极反应式为 ______。
“方法二”是先将![]() 与
与![]() 、C反应得到
、C反应得到![]() ,再用镁还原得到
,再用镁还原得到![]() 。因下述反应难于发生:
。因下述反应难于发生:
![]() 所以不能直接由
所以不能直接由![]() 和
和![]() 反应
反应![]() 即氯化反应
即氯化反应![]() 来制取
来制取![]() 。当往氯化反应体系中加入碳后,碳与上述反应发生耦合,使得反应在高温条件下能顺利进行。
。当往氯化反应体系中加入碳后,碳与上述反应发生耦合,使得反应在高温条件下能顺利进行。
![]() 已知:
已知:![]()
![]() 。请写出
。请写出![]() 与
与![]() 、C反应制各
、C反应制各![]() 的热化学方程式: ______。
的热化学方程式: ______。
![]() 从化学平衡的角度解释:往氯化反应体系中加入碳时,氯化反应能顺利进行的原因_______________。
从化学平衡的角度解释:往氯化反应体系中加入碳时,氯化反应能顺利进行的原因_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室从含碘废液![]() 含有
含有![]() 、
、![]() 、
、![]() 、
、![]() 等
等![]() 中回收碘,操作过程如下:
中回收碘,操作过程如下:

![]() 向废液中加入
向废液中加入![]() 溶液,发生“还原”反应的离子方程式为 ______。
溶液,发生“还原”反应的离子方程式为 ______。
![]() “氧化”操作在三颈烧瓶中进行,将溶液用盐酸调至pH约为2,缓慢通入
“氧化”操作在三颈烧瓶中进行,将溶液用盐酸调至pH约为2,缓慢通入![]() 。实验用水浴控制在
。实验用水浴控制在![]() 左右的较低温度下进行的原因是 ______。
左右的较低温度下进行的原因是 ______。

![]() 某研究小组用图装置对
某研究小组用图装置对![]() 与KI溶液的反应进行探究,发现通入
与KI溶液的反应进行探究,发现通入![]() 一段时间后,KI溶液变为黄色,继续通入
一段时间后,KI溶液变为黄色,继续通入![]() ,则溶液黄色变浅,最后变为无色.研究小组对所得无色溶液中碘元素的存在形态提出了以下假设:
,则溶液黄色变浅,最后变为无色.研究小组对所得无色溶液中碘元素的存在形态提出了以下假设:

假设一:没有![]() 形态;假设二:没有
形态;假设二:没有![]() 形态;假设三:有
形态;假设三:有![]() 形态。
形态。
![]() 请设计实验证明假设一成立
请设计实验证明假设一成立![]() 试剂自选
试剂自选![]() 。
。
实验操作 | 预期现象 | 结论 |
_______ | _______ | 假设一成立 |
![]() 若假设三成立,请写出生成
若假设三成立,请写出生成![]() 的离子方程式 ______。
的离子方程式 ______。
![]() 该研究小组还进行了对加碘盐中
该研究小组还进行了对加碘盐中![]() 含量测定的如下实验:
含量测定的如下实验:
![]() 准确称取加碘盐mg于烧杯中,加入适量蒸馏水和过量的KI,再滴入适量的稀硫酸,充分反应,将所得混合液配成
准确称取加碘盐mg于烧杯中,加入适量蒸馏水和过量的KI,再滴入适量的稀硫酸,充分反应,将所得混合液配成![]() 待测溶液.移取
待测溶液.移取![]() 待测溶液于锥形瓶中,加几滴淀粉试液,用c
待测溶液于锥形瓶中,加几滴淀粉试液,用c![]()
![]() 标准液滴定至终点,重复3次,测得平均值为VmL。
标准液滴定至终点,重复3次,测得平均值为VmL。
已知:![]() ,
,![]() 。测定时,判断达到滴定终点的现象为 ______ ,由测定数据可求得该样品中含
。测定时,判断达到滴定终点的现象为 ______ ,由测定数据可求得该样品中含![]() 的质量分数为 ______
的质量分数为 ______ ![]() 用含m、c、V的代数式表示,
用含m、c、V的代数式表示,![]()
![]() 。
。
![]() 在滴定操作正确无误的情况下,用此种测定方法测得的结果往往偏高,其原因是受空气的影响,请用离子方程式表示产生这一影响的原因 ______。
在滴定操作正确无误的情况下,用此种测定方法测得的结果往往偏高,其原因是受空气的影响,请用离子方程式表示产生这一影响的原因 ______。
查看答案和解析>>
科目: 来源: 题型:
【题目】在铜、锌、稀硫酸构成的原电池中(如图所示)
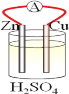
(1)负极是__________(填“铜”或“锌”),_________电子(填“失去”或“得到”),发__________(填“氧化”或 “还原”),电极反应方程式______________;
(2)电流由__________流向__________(填“铜”或“锌),铜片上观察到的现象是________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】乙醇是一种常用的工业燃料,乙醇的生产过程可用下图表示:

已知:![]() 。
。
(1)粉碎玉米的目的是____________________。
(2)请写出“发酵”过程中发生反应的化学方程式_________________;发酵产生的CO2的纯度可达到99%,可回收利用,请举出它的两项用途:________________、_________________。
(3)操作a的名称是_____________,检验乙醇中是否含有水可以用试剂 ________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com