
科目: 来源: 题型:
【题目】(1)50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热,回答下列问题:

①从实验装置上看,图中尚缺少的一种玻璃用品是______。
②大烧杯上如不盖硬纸板,求得的中和热数值将________ (填“ 偏大”“偏小”或“无影响”)。
(2)酸碱中和滴定是中学化学常见实验。
某学校化学课外小组用0.2000 mol·L-1盐酸滴定未知浓度的氢氧化钠溶液,试回答下列问题。
①滴定过程中,眼睛应注视_____________________________________。
②在铁架台上垫一张白纸,其目的是_____________________________。
③根据下表数据,计算被测烧碱溶液的物质的量浓度是____mol·L-1。(保留四位有效数字)
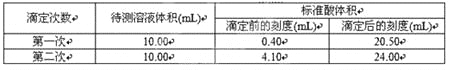
④下列实验操作对滴定结果产生什么影响(填“偏高”、“偏低”或“无影响”)?
a.观察酸式滴定管液面时,开始俯视,滴定终点平视,则滴定结果________。
b.若将锥形瓶用待测液润洗,然后再加入10.00 mL待测液,则滴定结果_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】电渗析法是一种利用离子交换膜进行海水淡化的方法,原理如图所示,淡水最终在X和Z室中流出。下列说法不正确的是
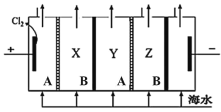
A.一般海水中含有的 Ca2+、Mg2+容易生成沉淀堵塞离子交换膜,因此不能直接通入阴极室
B.阳极发生电极反应:2Cl2e=Cl2↑
C.电渗析过程中阴极附近pH值升高
D.A膜为阳离子交换膜,B膜为阴离子交换膜
查看答案和解析>>
科目: 来源: 题型:
【题目】可逆反应mA(g)+nB(g) ![]() pC(g)+qD(g)的v-t图象如下图,如若其它条件不变,只是在反应前加入合适的催化剂,则其v-t图象如下图:
pC(g)+qD(g)的v-t图象如下图,如若其它条件不变,只是在反应前加入合适的催化剂,则其v-t图象如下图:
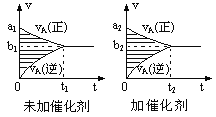
①a1>a2 ②a1<a2 ③b1>b2 ④b1<b2 ⑤t1>t2 ⑥t1=t2 ⑦两图中阴影部分面积相等 ⑧右图中阴影部分面积更大,以上说法中正确的是
A. ②④⑤⑦B. ①④⑥⑧C. ②③⑤⑧D. ①③⑥⑦
查看答案和解析>>
科目: 来源: 题型:
【题目】下列图示与对应的叙述不相符合的是( )

A.图1表示相同温度下,向pH=10的氢氧化钠溶液和氨水中分别加水稀释时pH变化曲线,其中a表示氨水稀释时pH的变化曲线
B.图2表示已达平衡的某反应,在t0时改变某一条件后反应速率随时间变化,则改变的条件一定是加入催化剂
C.图3表示工业上用CO生产甲醇的反应CO(g)+2H2(g)![]() CH3OH(g),该反应的ΔH=-91 kJ·mol-1
CH3OH(g),该反应的ΔH=-91 kJ·mol-1
D.图4表示10 mL 0.01 mol·L-1酸性KMnO4溶液与过量的0.1 mol·L-1H2C2O4溶液混合时,n(Mn2+)随时间的变化(Mn2+对该反应有催化作用)
查看答案和解析>>
科目: 来源: 题型:
【题目】某学生用标准0.1400molL-1NaOH溶液滴定未知浓度硫酸的实验操作如下。
A.用酸式滴定管取稀H2SO425.00mL,注入锥形瓶中,加入酚酞。
B.用待测定的溶液润洗酸式滴定管
C.用蒸馏水洗干净滴定管
D.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2-3cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下
E.检查滴定管是否漏水
F.另取锥形瓶,再重复操作一次
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度,用去NaOH溶液15.00mL。
(1)①滴定操作的正确顺序是(用序号填写)___;②在G操作中如何确定终点?___。
(2)碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果(填“偏小”、“偏大”或“恰好合适”)___。
(3)配制100mLNaOH标准溶液,必须使用到的玻璃仪器是___。
(4)观察碱式滴定管读数时,若滴定前仰视,滴定后俯视,则结果会导致测得的稀H2SO4溶液浓度测定值___(选填“偏大”“偏小”或“无影响”)
(5)计算待测硫酸溶液的物质的量浓度___。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,向20 mL 0.1 mol·L1的HA溶液中逐滴加入0.1mol·L1的NaOH溶液,溶液中水所电离的c水(H+)随加入NaOH溶液体积的变化如图所示,下列说法正确的是
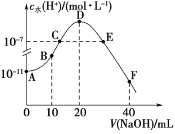
A.HA的电离常数Ka约为1×105
B.B点的溶液中粒子浓度满足关系:c(HA)>c(Na+)>c(A)
C.C、E两点因为对水的电离的抑制作用和促进作用相同,所以溶液均呈中性
D.F点的溶液呈碱性,粒子浓度满足关系c(OH)=c(HA)+c(A)+c(H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】研究苯酚与FeCl3溶液的显色反应,实验如下。下列说法不正确的是
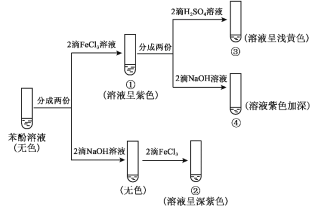
A.对比①③中的现象,说明滴加稀硫酸后,c(Fe3+)变小
B.向试管②中滴加硫酸至过量,溶液颜色变为浅黄色
C.对比①②、①④中的现象,说明紫色物质的生成与溶液中 c(C6H5O)相关
D.对比①②、①④中的现象,说明结合C6H5O的能力:H+>Fe3+
查看答案和解析>>
科目: 来源: 题型:
【题目】漂白剂亚氯酸钠(NaClO2)在常温与黑暗处可保存一年,亚氯酸不稳定可分解,反应的离子方程式为:5HClO2===4ClO2↑+H++Cl-+2H2O。(HClO2为弱酸)向NaClO2溶液中滴加H2SO4,开始时HClO2分解反应缓慢,随后反应迅速加快,其原因是
A. 溶液中的Cl-起催化作用 B. 溶液中的H+起催化作用
C. ClO2逸出,使反应的生成物浓度降低 D. 在酸性条件下,亚氯酸钠的氧化性增强
查看答案和解析>>
科目: 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种集氧化、杀菌、脱色、除臭的新型高效水处理剂,工业上可通过 Fe(NO3)3 与NaClO在强碱性介质中反应生成紫红色高铁酸盐溶液,其对应的工业流程如图所示。有关说法正确的是( )
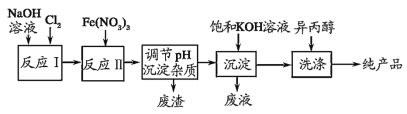
A.K2FeO4能够作为净水剂的原因,在于其氧化产物能够水解生成氢氧化铁胶体
B.反应II的离子方程式为 3ClO+5H2O+2Fe3+=2![]() +3Cl+10H+
+3Cl+10H+
C.向Na2FeO4 中加入饱和KOH 溶液,析出K2FeO4 沉淀,说明K2FeO4 的溶解度比Na2FeO4 大
D.洗涤粗品时选用异丙醇而不用水,可以减少K2FeO4的溶解损失
查看答案和解析>>
科目: 来源: 题型:
【题目】某密闭容器中发生反应:X(g)+3Y(g)![]() 2Z(g) ΔH<0。如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是( )
2Z(g) ΔH<0。如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是( )
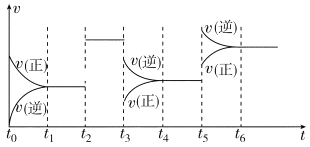
A.t2时加入了催化剂B.t3时降低了温度
C.t5时增大了压强D.t4~t5时间内X转化率最低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com