
【题目】研究苯酚与FeCl3溶液的显色反应,实验如下。下列说法不正确的是
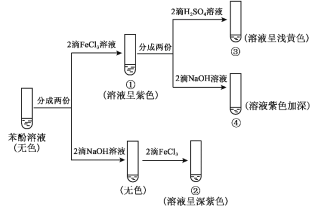
A.对比①③中的现象,说明滴加稀硫酸后,c(Fe3+)变小
B.向试管②中滴加硫酸至过量,溶液颜色变为浅黄色
C.对比①②、①④中的现象,说明紫色物质的生成与溶液中 c(C6H5O)相关
D.对比①②、①④中的现象,说明结合C6H5O的能力:H+>Fe3+
【答案】A
【解析】
A.①中溶液为紫色,③中溶液为浅黄色,可知滴加稀硫酸后,c(Fe3+)增大,故A错误;
B.加硫酸,酸性增强,使平衡Fe3++6C6H5OH![]()
![]() +3H+逆向移动,溶液颜色变为浅黄色,故B正确;
+3H+逆向移动,溶液颜色变为浅黄色,故B正确;
C.对比①②、①④中的现象,平衡正向进行程度越大,紫色越深,则紫色物质的生成与溶液中 c(C6H5O-)相关,故C正确;
D.苯酚溶液中滴加FeCl3溶液后溶液中存在Fe3++6C6H5OH![]()
![]() +3H+,比较①②,①是苯酚与氯化铁溶液反应,而②则是苯酚钠溶液与等量的氯化铁溶液,但是①的颜色不如②的深,说明①中
+3H+,比较①②,①是苯酚与氯化铁溶液反应,而②则是苯酚钠溶液与等量的氯化铁溶液,但是①的颜色不如②的深,说明①中![]() 的浓度不如②的大,故说明H+结合C6H5O的能力>Fe3+,比较可知①的颜色比④的浅,是由于④中加入了NaOH溶液,消耗了H+,使Fe3++6C6H5OH
的浓度不如②的大,故说明H+结合C6H5O的能力>Fe3+,比较可知①的颜色比④的浅,是由于④中加入了NaOH溶液,消耗了H+,使Fe3++6C6H5OH![]()
![]() +3H+平衡正向移动,故说明溶液中H+结合C6H5O的能力>Fe3+,故D正确;
+3H+平衡正向移动,故说明溶液中H+结合C6H5O的能力>Fe3+,故D正确;
故答案为:A。


 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:
【题目】已知H2SO3HSO3-+H+,Ka1;HSO3-SO32-+H+,Ka2。常温下,向某浓度的H2SO3溶液中逐滴加入一定量浓度的NaOH溶液,所得溶液中H2SO3、HSO3-、SO32-三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是( )
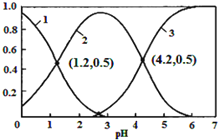
A.pH=1.2溶液中:c(Na+)+c(H+)=c(OH-)+c(H2SO3)
B.常温下,![]() =1000
=1000
C.向pH=1.2的溶液中加KOH溶液将pH增大至4.2的过程中水的电离度先增大后减小
D.曲线3表示的微粒是SO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中有关微粒的物质的量浓度关系不正确的是( )
A.物质的量浓度相等的Na2S和NaHS混合溶液中:c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-)
B.常温下将醋酸钠、盐酸两溶液混合后溶液呈中性,则混合后溶液中:c(Na+)=c(CH3COO-)>c(OH-)=c(H+)
C.常温下c(NH4+)相等的①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2三种溶液中,溶质的物质的量浓度大小:①>②>③
D.等体积、等物质的量浓度的NaX和弱酸HX混合后呈酸性的溶液中:c(X-)>c(Na+)>c(HX)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验是化学学习中非常重要的内容,根据下面两个实验回答问题。
(一)某研究小组进行Mg(OH)2沉淀溶解和生成的实验探究。
(查阅资料)25℃时,Ksp[Mg(OH)2]=1.8×10-11,Ksp[Fe(OH)3]=4.0×10-38
(实验探究)向2支均盛有1mL0.1mol/LMgCl2溶液的试管中分别加入2滴2mol/L NaOH溶液,制得等量Mg(OH)2沉淀。
(1)分别向两支试管中加入不同试剂,记录实验现象如表:(表中填空填下列选项中字母代号)
试管编号 | 加入试剂 | 实验现象 |
Ⅰ | 2滴0.1mol/LFeCl3溶液 | ①_____ |
Ⅱ | 4mL2mol/LNH4Cl溶液 | ②_____ |
A.白色沉淀转化为红褐色沉淀 B.白色沉淀不发生改变
C.红褐色沉淀转化为白色沉淀 D.白色沉淀溶解,得无色溶液
(2)同学们猜想实验Ⅱ中沉淀溶解的主要原因有两种:
猜想1:NH4+结合Mg(OH)2电离出的OH-,使Mg(OH)2的溶解平衡正向移动。
猜想2:____________________________________________________________。
(3)为验证猜想,同学们取少量相同质量的氢氧化镁盛放在两支试管中,一支试管中加入醋酸铵溶液(pH=7),另一支试管中加入NH4Cl和氨水混合液(pH=8),两者沉淀均溶解。该实验证明猜想正确的是____(填 “1”或“2”)。
(二)测定某品牌的碘盐(含有碘酸钾)中碘元素的百分含量。准确称取5.000 0 g该碘盐,溶于蒸馏水,然后与足量的KI溶液在酸性条件下混合(发生的反应为KIO3+3H2SO4+5KI===3K2SO4+3I2+3H2O),充分反应后将混合溶液稀释至250 mL,然后取25.00 mL用5.0×10-4 mol·L-1的Na2S2O3标准溶液进行滴定(用淀粉作指示剂,反应为I2+2S2O32-===2I-+S4O62-)。有关实验数值如下表所示。
滴定次数 | 待测液的体积(mL) | 滴定前的读数(mL) | 滴定后的读数(mL) |
第一次 | 25.00 | 0.00 | 15.90 |
第二次 | 25.00 | 0.00 | 14.99 |
第三次 | 25.00 | 0.00 | 15.01 |
该碘盐中碘元素的百分含量为________。(保留三位有效数字)下列操作中,会导致所测得的碘元素的百分含量偏大的是________。
a.滴定终时,俯视刻度
b.没有用Na2S2O3标准溶液润洗相应的滴定管
c.锥形瓶中有少量的蒸馏水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二酸(HOOC﹣COOH,可简写为H2C2O4)俗称草酸,在100℃开始升华,157℃时开始分解。用酸性KMnO4溶液滴定含杂质的Na2C2O4样品(已知杂质不与KMnO4和H2SO4溶液反应)。
实验步骤:
准确称取1g样品Na2C2O4固体,配成100mL溶液,取出20.00mL于锥形瓶中。再向瓶中加入足量稀H2SO4溶液,用0.016mol/L高锰酸钾溶液滴定,滴定至终点时消耗高锰酸钾溶液25.00mL。(已知:5H2C2O4+2KMnO4+3H2SO4=10CO2↑+2MnSO4+K2SO4+8H2O)
(1)高锰酸钾溶液应装在______________________________滴定管中。(填“酸式”或“碱式”)
(2)滴定至终点时的实验现象是:___________________________________
(3)下列操作可能使测量结果偏高的是__________________________________;
A、盛装的Na2C2O4的滴定管没润洗
B、盛装高锰酸钾溶液的滴定管滴定前尖嘴处有气泡,滴定后气泡消失
C、读数时滴定前仰视,滴定后俯视
D、锥形瓶中残留少量水
(4)计算样品中Na2C2O4的纯度___________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电渗析法是一种利用离子交换膜进行海水淡化的方法,原理如图所示,淡水最终在X和Z室中流出。下列说法不正确的是
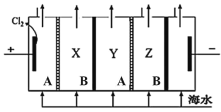
A.一般海水中含有的 Ca2+、Mg2+容易生成沉淀堵塞离子交换膜,因此不能直接通入阴极室
B.阳极发生电极反应:2Cl2e=Cl2↑
C.电渗析过程中阴极附近pH值升高
D.A膜为阳离子交换膜,B膜为阴离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用硼镁矿![]() 主要成分为
主要成分为![]() ,含少量
,含少量![]() 和
和![]() 制取粗硼的工艺流程为:
制取粗硼的工艺流程为:
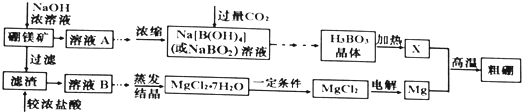
已知:![]() 硼与铝的性质相似,也能与氢氧化钠溶液反应.
硼与铝的性质相似,也能与氢氧化钠溶液反应.
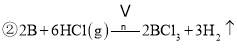
![]() 的熔点为
的熔点为![]() ,沸点为
,沸点为![]() ,在潮湿空气中易形成白雾.
,在潮湿空气中易形成白雾.
I.回答下列问题:
![]() 证明溶液B中含有铁元素的方法是 ______
证明溶液B中含有铁元素的方法是 ______
![]() 与X反应制取粗硼的化学方程式 ______
与X反应制取粗硼的化学方程式 ______
![]() 上图中制取
上图中制取![]() 的“一定条件”是指 ______
的“一定条件”是指 ______
![]() 某同学设计如图所示装置制备三氯化硼.
某同学设计如图所示装置制备三氯化硼.

回答下列问题:
![]() 装置的作用是 ______ .
装置的作用是 ______ .
![]() 如果去掉B装置,可能的后果是 ______ .
如果去掉B装置,可能的后果是 ______ .

![]() 装置后面还应连接的一个装置是 ______ .
装置后面还应连接的一个装置是 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用水钴矿(主要成分为Co2O3,还含少量Fe2O3、Al2O3、MgO、CaO等杂质)制备钴的氧化物,其制备工艺流程如下(已知Na2SO3能还原Fe3+和Co3+):

回答下列问题:
(1)在加入盐酸进行“酸浸”时,能提高“酸浸”速率的方法有______________(任写2种)。
(2)“酸浸”后加入Na2SO3钴的存在形式为Co2+,产生Co2+反应的离子方程式为________
(3)溶液a中加入NaClO的作用是___________________________________
(4)沉淀a的成分是__________(写化学式),操作2的名称是_______________
(5)溶液d中的金属离子只有Co2+和Na+两种,则溶液c中加入NaF溶液的作用是________
(6)在空气中缎烧CoC2O4生成钴的某种氧化物和CO2,测得充分煅烧后固体质量为12.05g,CO2的体积为6.72L(标准状况),则此反应的化学方程式为____________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应CO(g)+H2O(g)![]() CO 2(g)+ H 2(g) △H﹤0,在其他条件不变的情况下
CO 2(g)+ H 2(g) △H﹤0,在其他条件不变的情况下
A. 加入催化剂,改变了反应的途径,反应的△H也随之改变
B. 改变压强,平衡不发生移动,反应放出的热量不变
C. 升高温度,反应速率加快,反应放出的热量不变
D. 若在原电池中进行,反应放出的热量不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com