
科目: 来源: 题型:
【题目】以甲醇为原料制取高纯H2是重要的研究方向。回答下列问题:
(1)甲醇水蒸气重整制氢主要发生以下两个反应。
主反应:CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g) △H=+49kJ·mol-1
CO2(g)+3H2(g) △H=+49kJ·mol-1
副反应:H2(g)+CO2(g) ![]() CO(g)+H2O(g) △H=+41kJ·mol-1
CO(g)+H2O(g) △H=+41kJ·mol-1
①甲醇在催化剂作用下裂解可得到H2和CO,反应的热化学方程式为__________________,既能加快反应速率又能提高CH3OH平衡转化率的一种措施是_________________________。
②适当增大水醇比[n(H2O):n(CH3OH)],有利于甲醇水蒸气重整制氢,理由是___________。
③某温度下,将n(H2O):n(CH3OH)=1:1的原料气充入恒容密闭容器中,初始压强为p1,反应达到平衡时总压强为p2,则平衡时甲醇的转化率为_________________(忽略副反应)。
(2)工业上常用CH4与水蒸气在一定条件下来制取H2,其反应原理为:CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H=+203kJ·mol-1,在容积为3L的密闭容器中通入物质的量均为3mol的CH4和水蒸气,在一定条件下发生上述反应,测得平衡时H2的体积分数与温度及压强的关系如图所示。
CO(g)+3H2(g) △H=+203kJ·mol-1,在容积为3L的密闭容器中通入物质的量均为3mol的CH4和水蒸气,在一定条件下发生上述反应,测得平衡时H2的体积分数与温度及压强的关系如图所示。
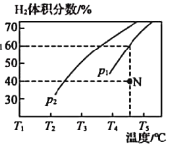
压强为p1时,在N点:v正_______v逆(填“大于”“小于”或“等于”),N点对应温度下该反应的平衡常数K=________mol2·L-2。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,向20mL某浓度的硫酸溶液中滴入0.1molL-1氨水,溶液中水电离出的氢离子浓度随加入氨水的体积变化如图,下列分析正确的是( )
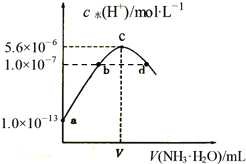
A.V=40
B.c点所示溶液中:c(H+)-c(OH-)=2c(NH3H2O)
C.d点所示溶液中:c(NH4+)=2c(SO42-)
D.NH3H2O的电离常数K=10-4molL-1
查看答案和解析>>
科目: 来源: 题型:
【题目】在2A (g)+B (g) ![]() 2C(g) +D(s)反应中,表示该反应速率最快的是
2C(g) +D(s)反应中,表示该反应速率最快的是
A. v(A)=0.8mol/(Ls) B. vB=0.3mol/(Ls) C. vC=0.6mol/(Ls) D. vD=0.5mol/(Ls)
查看答案和解析>>
科目: 来源: 题型:
【题目】铅蓄电池反应为:Pb(s)+PbO2(s)+2H2SO4(aq)![]() 2PbSO4(s)+2H2O(l)。下列说法正确的是( )
2PbSO4(s)+2H2O(l)。下列说法正确的是( )
A.放电时Pb为正极,发生还原反应
B.放电时电解质溶液中的H+向负极移动
C.充电时阳极的电极反应为:PbSO4(s)-2e-=Pb(s)+SO![]() (aq)
(aq)
D.充电时阳极附近电解质溶液的pH逐渐减小
查看答案和解析>>
科目: 来源: 题型:
【题目】(题文)海带含有丰富的碘,为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
请填写下列空白:
(1)步骤③和⑤的实验操作名称分别是________________、____________。
(2)步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤应选择的实验装置是________,该装置的操作名称为__________。
(3)步骤④反应的离子方程式是___________________________。
(4)请设计一个简单的实验方案,检验提取碘后的水溶液中是否还含有单质碘:______。
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、W是中学常见的四种短周期元素,其原子序数依次增大,且原子核外最外层电子数都不少于2,X与W的最外层电子数相等。四种元素的单质均能在氧气中燃烧,生成四种相对分子质量都大于26的氧化物,其中有两种氧化物能溶于稀硫酸,三种氧化物能溶于烧碱溶液。四种元素的单质所形成的混合物有如下性质:
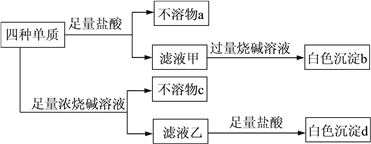
下列说法正确的是
A.原子半径:X>Y>Z>W
B.简单的气态氢化物的热稳定性:W>X
C.最高价氧化物对应水化物的碱性:Z>Y
D.X和W组成的化合物常作砂纸、砂轮的磨料
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,水的电离可达到平衡:H2O![]() H++OH- △H>0,下列叙述正确的是
H++OH- △H>0,下列叙述正确的是
A. 向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
B. 向水中加入稀氨水,平衡逆向移动,c(OH-)降低
C. 向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D. 将水加热,Kw增大,pH不变
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述不正确的是( )
A.0.1molL-1NaOH溶液与0.2molL-1CH3COOH溶液等体积混合后:c(CH3COOH)+c(CH3COO-)=0.1molL-1
B.常温下,将CH3COONa和HCl两溶液混合呈中性的溶液中:c(Na+)>c(Cl-)=c(CH3COOH)
C.pH相等的①NH4Cl、②(NH4)2SO4、③NH4HSO4溶液,c(NH4+)大小顺序为①=②>③
D.25℃时,pH=a的盐酸与pH=b的Ba(OH)2溶液等体积混合后,恰好完全反应,则a+b=13
查看答案和解析>>
科目: 来源: 题型:
【题目】氨在化肥生产、贮氢及燃煤烟气脱硫脱硝等领域用途非常广泛.
![]() 尿素
尿素![]() 与氰酸铵
与氰酸铵![]() 互为 ______ ;氰酸铵属于 ______ 化合物
互为 ______ ;氰酸铵属于 ______ 化合物![]() 选填:“离子”或“共价”
选填:“离子”或“共价”![]() 。
。
![]() 液氨是一种贮氢材料,气态氨转变为液氨将 ______ 能量
液氨是一种贮氢材料,气态氨转变为液氨将 ______ 能量![]() 选填:“吸收”或“释放”
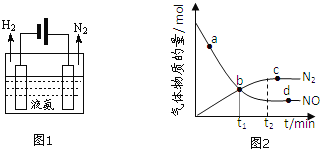
选填:“吸收”或“释放”![]() 液氨可通过图1装置释放氢气,该过程中能量转化方式为 ______ 。
液氨可通过图1装置释放氢气,该过程中能量转化方式为 ______ 。
![]() 氨气可作为脱硝剂,在恒温恒容密闭容器中充入一定量的NO和
氨气可作为脱硝剂,在恒温恒容密闭容器中充入一定量的NO和![]() ,在一定条件下发生反应:
,在一定条件下发生反应:![]() 。
。
①能说明该反应已达到平衡状态的标志是 ______ ![]() 不定项选择
不定项选择![]() 。
。
![]() 反应速率
反应速率![]()
![]()
![]()
![]() 容器内压强不再随时间而发生变化
容器内压强不再随时间而发生变化
![]() 容器内
容器内![]() 的物质的量分数不再随时间而发生变化
的物质的量分数不再随时间而发生变化
![]() 容器内
容器内![]() :
:![]() :
:![]() :
:![]() :4:5:6
:4:5:6
②某次实验中测得容器内NO及![]() 的物质的量随时间变化如图2所示,图中
的物质的量随时间变化如图2所示,图中![]() 正
正![]() 与
与![]() 逆
逆![]() 相等的点为 ______
相等的点为 ______ ![]() 选填字母
选填字母![]() 。
。
![]() 已知:断开1mol共价键吸收的能量或形成1mol共价键释放的能量数据如表
已知:断开1mol共价键吸收的能量或形成1mol共价键释放的能量数据如表
共价键 |
|
|
|
能量变化 | 436 |
| 946 |
则合成氨反应:![]()
![]() ______
______ ![]()
![]() 工业上用氨水吸收硫酸工业尾气中的
工业上用氨水吸收硫酸工业尾气中的![]() ,既可消除污染又可获得
,既可消除污染又可获得![]() 等产品.若用1000kg 含
等产品.若用1000kg 含![]() 质量分数为
质量分数为![]() 的氨水吸收
的氨水吸收![]() 且全部转化为
且全部转化为![]() ,不考虑其它成本,则可获得的利润为 ______ 元
,不考虑其它成本,则可获得的利润为 ______ 元![]() 参照下面的价格表
参照下面的价格表![]() 。
。
| 无水 | |
价格 |
|
|
查看答案和解析>>
科目: 来源: 题型:
【题目】 X、Y、Z、W均为短周期元素,他们在元素周期表的位置如下图所示。若Y原子的最外层电子数与电子总数之比为3:4,下列说法正确的是

A. 原子半径:W>Z>Y>X
B. 最高价氧化物对应水化物的酸性:Z>W>X
C. 气态氢化物的稳定性:Z>W
D. W的单质能与水反应,生成一种具有漂白性的物质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com