
科目: 来源: 题型:
【题目】美国科学家目前开发出了一种新技术,将能放射出![]() 粒子的砹原子装入形状类似DNA螺旋结构的碳纳米管中,这种肉眼看不见的微型“核弹”可以搜索、确认并定向摧毁身体任何部位的癌细胞.下列有关说法中正确的是( )
粒子的砹原子装入形状类似DNA螺旋结构的碳纳米管中,这种肉眼看不见的微型“核弹”可以搜索、确认并定向摧毁身体任何部位的癌细胞.下列有关说法中正确的是( )
A.放射性At原子中,核外电子与核内中子数之差为133
B.根据元素周期律推知:砹单质是![]() 种有色固体,AgAt是一种不溶于水的固体
种有色固体,AgAt是一种不溶于水的固体
C.类似DNA螺旋结构的碳纳米管是一种高分子化合物
D.构成碳纳米管的微粒直径在![]() 之间,它实际上是一种胶体
之间,它实际上是一种胶体
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是元素周期表前四周期的一部分,关于元素X、Y、Z的叙述错误的是

A. X的气态氢化物与Y的最高价氧化物的水化物能反应生成盐
B. 等物质的量浓度的X、Y、Z的气态氢化物的水溶液的pH:X>Y>Z
C. Z的单质常温下是液体,可与铁粉反应
D. Z的原子序数比Y大9
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,向1.0L密闭容器中加入0.60molX(g),发生反应X(g)=Y(s)+2Z(g) ΔH>0,反应达到最大限度前,测得X的浓度与反应时间的数据如表所示:
反应时间t/min | 0 | 1 | 2 | 3 | 4 | 6 | 8 |
c(X)/mol·L-1 | 0.60 | 0.42 | 0.30 | 0.21 | 0.15 | a | 0.0375 |
试回答下列问题:
(1)0~3min内,用Z表示的平均反应速率v(Z)=___。
(2)分析该反应中反应物的浓度随时间的变化规律,得出的结论是___。由此结论推出a为___。
(3)该反应的逆反应速率随时间变化的关系如图所示,t2时改变了某一反应条件,则改变的条件为___。
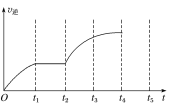
查看答案和解析>>
科目: 来源: 题型:
【题目】下列物质属于同系物的是( )
A. ![]() 与
与![]() B. CH3CH2Cl与CH2ClCH2CH2Cl
B. CH3CH2Cl与CH2ClCH2CH2Cl
C. C2H5OH与CH3OH D. CH3CH2CH3与CH2=CHCH3
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是部分短周期主族元素原子半径与原子序数的关系图。下列说法正确的是( )
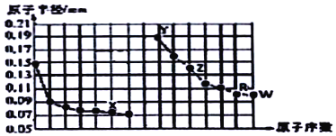
A.X所在主族中,X的简单氢化物分子间存在氢键,所以其氢化物稳定性最强
B.R简单氢化物的酸性弱于W简单氢化物,故元素非金属性R小于W
C.在同周期中,W的含氧酸酸性最强
D.Y的氢化物可以与水反应,产生一种单质气体
查看答案和解析>>
科目: 来源: 题型:
【题目】某学生用0.200 0 mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴处充满液体;
③调节液面至“0”或“0”刻度线以下,并记下读数;
④移取20.00 mL待测液注入洁净的还存有少量蒸馏水的锥形瓶中,并加入3滴酚酞试液;
⑤用标准液滴定至终点,记下滴定管液面读数。
请回答下列问题:
(1)以上步骤有错误的是____。
(2)用标准的NaOH溶液滴定待测的盐酸时,左手握_______(填“酸式”或“碱式”)滴定管的活塞,右手摇动锥形瓶,眼睛注视_______________判断滴定终点的现象是____________________。
(3)若测定结果偏高,其原因可能是_____。
a.配制标准溶液的固体NaOH中混有KOH杂质
b.滴定终点读数时,仰视滴定管的刻度,其他操作正确
c.盛装待测液的锥形瓶用蒸馏水洗过后未用待测液润洗
d.滴定管滴定前无气泡,滴定后有气泡
(4)如图是某次滴定时的滴定管中的液面,其读数为_____mL。
![]()
(5)根据下列数据,请计算待测盐酸的浓度:_________mol·L-1。
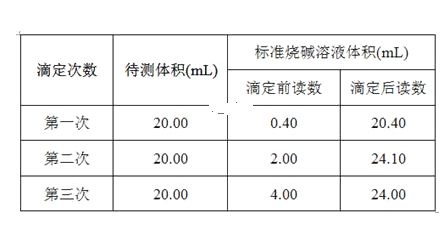
查看答案和解析>>
科目: 来源: 题型:
【题目】铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。已知氯化铁是一种重要的化工原料,无水氯化铁遇潮湿空气极易吸水生成![]()
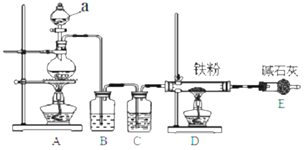
(1)某学习小组用如图装置在实验室制备无水氯化铁,请你一起参与该小组的活动。
①装置A 中仪器 a的名称是 ______ 。
②装置B的作用是 ______ ,C 中的试剂 ______ 。
③实验开始时先点燃 ______ 处酒精灯;装置 E的作用为 ______ 。
(2)工业上制备无水氯化铁的一种工艺流程如下:
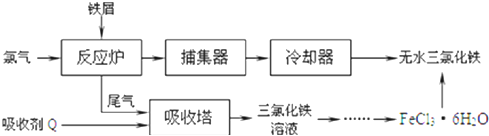
①吸收塔中发生反应的离子方程式为 ______
②简述由![]() 晶体得到无水氯化铁的操作: ______
晶体得到无水氯化铁的操作: ______
查看答案和解析>>
科目: 来源: 题型:
【题目】溶液中的化学反应大多是离子反应。根据要求回答下列问题:
(1)盐碱地(含较多Na2CO3、NaCl)不利于植物生长,试用化学方程式表示:盐碱地产生碱性的原因:______________;农业上用石膏降低其碱性的反应原理:__________。
(2)若取pH、体积均相等的NaOH溶液和氨水分别用水稀释m倍、n倍,稀释后pH仍相等,则m________(填“>”“<”或“=”)n。
(3)常温下,在pH=6的CH3COOH与CH3COONa的混合溶液中水电离出来的c(OH-)=__________。
(4)25 ℃时,将a mol·L-1氨水与0.01 mol·L-1盐酸等体积混合,反应平衡时溶液中c(![]() )=c(Cl-),则溶液显________(填“酸”“碱”或“中”)性。用含a的代数式表示NH3·H2O的电离常数Kb=________。
)=c(Cl-),则溶液显________(填“酸”“碱”或“中”)性。用含a的代数式表示NH3·H2O的电离常数Kb=________。
查看答案和解析>>
科目: 来源: 题型:
【题目】将质量相等的铁片和铜片用导线相连浸入500 mL硫酸铜溶液中构成如图的装置:
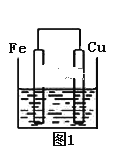
(以下均假设反应过程中溶液体积不变)。
(1)铁片上的电极反应式为______________,
(2)铜片周围溶液会出现___________的现象。
(3)若2 min后测得铁片和铜片之间的质量差为3.6 g,计算:导线中流过的电子的物质的量为__________mol;
(4)人们应用原电池原理制作了多种电池,以满足不同的需要。燃料电池是一种高效、环境友好的供电装置,科学家用乙烷C2H6作为燃料,氧气作助燃剂,铂作电极,稀硫酸溶液为电解质溶液。制作了一个燃料电池,提高了乙烷的利用效率乙烷燃料电池的正极电极反应式:_____________。负极电极反应式:_________电池工作一段时间后电解质溶液的PH_____________(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】有①氨水 ②NH4Cl溶液 ③Na2CO3溶液 ④NaHCO3溶液各25 mL,物质的量浓度均为0.1 mol/L,下列说法正确的是
A. 4种溶液pH的大小顺序:①>④>③>②
B. 溶液①、②等体积混合后pH > 7,则c(NH4+) < c(NH3·H2O)
C. 向溶液①、②中分别加入25 mL 0.1mol/L盐酸后,溶液中c(NH4+):①>②
D. 向溶液③、④中分别加入12.5 mL 0.1mol/L NaOH溶液后,两溶液中的离子种类相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com